Abstracts of előadások általános kémia szerint készített az a követelmény - Kivonat - p
1.Atom - komplex részecske. Állapot Wat elektronokat.
1.1Atom - komplex részecske.
Atom - elektromosan rendszer kölcsönható elemi részecskék álló magok (protonok és neutronok képződik) és elektronok.
Elektronok, protonok és neutronok úgynevezett elemi részecskéket. Milyen tulajdonságokkal ezek a részecskék?
Korpuszkuláris-hullám tulajdonságait mikrovilágát. Elemi részecskék és gyártani atommagok, atomok és molekulák egy elhanyagolható súlya és méretei, és ezért azok különleges tulajdonságait nem hasonlóak, amelyek makrokozmoszt tárgyak körül bennünket. Ők alkotják a saját, külön világ - egy mikrokozmosz. aki él külön jogszabályok által diktált kvantummechanika - a tudomány szerkezete és tulajdonságai az elemi részecskék, magok, atomok és molekulák.
A kvantummechanika írja le a részecskék a mikrovilág tárgyként egy kettős jellege - a hullám-részecske kettősség. ők is a részecskék (vörösvértestek) és a hullámok.
Elektronikus - részecske meghatározza a legjellemzőbb kémiai tulajdonságait az atomok és molekulák. A kettős természete elektronok lehet megerősíteni, tapasztalat. Ha az elektronokat kibocsátott egy olyan forrásból, mint például a katód, átmennek a kis lyukak a lemez, meghatározott úton, kapnak egy fotográfiai lemezen, okozhat annak elfeketedését. Előhívás után a fotográfiai lemezt rajta látható egy sor váltakozó világos és sötét gyűrűk, azaz, a diffrakciós minta (1. ábra).
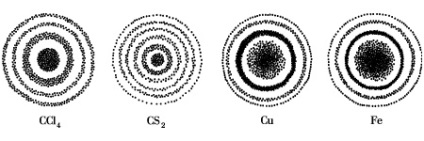
Az elektron gáz (balra) és kristályokat (jobbra).
A központi helyszínen által okozott a nem szórt elektronsugár,
és gyűrűk - elektronok szétszórva különböző szögekben
A diffrakciós mintázat magában foglalja mind a tényleges diffrakciós - hullám hajlító akadályok és az interferencia. vagyis kivetése hullámok egymásra. Ezek az események létezését bizonyítani az elektron hullám tulajdonságait, mivel csak a hullámok kanyar akadályok körül, és egymásra saját találkozóhely. Azonban egyre a fényérzékeny réteg, az elektron ad sötétedő csak egy helyen, ami azt jelzi, a jelenléte a korpuszkuláris tulajdonságait. Ha ő lett volna csak egy hullám, ez többé-kevésbé egyenletesen világítja meg a teljes lemezt tenné.
1.2Sostoyanie elektronok az atom
Electron egy atom nincs mozgás utat, meg lehet beszélni csak a valószínűsége, hogy ez a hely az atommag körül. Ez lehet bármely részén a tér körülveszi a magot, és több különböző helyzetben ez tekinthető az elektron felhő egy bizonyos negatív töltéssűrűség.
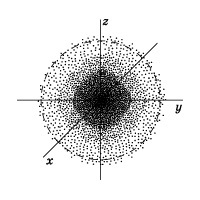
Ábra 2.pokazan „cut” az ilyen elektronsűrűség a hidrogénatom, áthalad a mag, és a szaggatott vonal által határolt területen belül elektron detektálás valószínűsége 90%. A legközelebb a mag áramkör tartalmaz egy régióban a tér, amelyben a valószínűsége, hogy egy elektron
10%, a valószínűsége, hogy egy elektron belül a második hurokban kernel
20% a harmadik -
Field elektron észlelési valószínűsége nincs egyértelmű határokat. Azonban lehet kiosztani a hely, ahol a valószínűsége, hogy az elektron maximális.
A tér az atommag körül, ahol a legtöbb a legvalószínűbb, hogy megtalálja az elektron, az úgynevezett pályák.
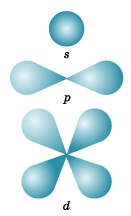
Ez nagyjából 90% -át az elektron felhő, és ez azt jelenti, hogy mintegy 90% -a az elektron ebben a részében helyet. A forma megkülönböztetésére négy jelenleg ismert típusú pályák, amelyek képviselik a római betűk s. o. d és f. Grafikus ábrázolás bizonyos formáinak elektron pályák a 3. ábrán látható.
A legfontosabb jellemzője az elektron mozgás egy meghatározott orbitális energia a kapcsolata a mag.
Az elektronok, amelyek az energia értékek legközelebb alkotnak egy egyrétegű vagy elektron energia szinten. Az energia szintek vannak számozva kezdve a nucleus: 1, 2, 3, 4, 5, 6 és 7.
Egy egész szám n. számát jelzi az energia szintet, az úgynevezett főkvantumszámú.
A száma energiaszintek (elektron kagyló) egy atom egyenlő az időszak száma a rendszerben a Mendeleev, amelyik egy kémiai elem: az atomok az elemek az első időszak - az egyik az energia szintet a második időszakban - két hetedik periódus - hét.
Maximális száma elektronok a energiaszintet határozza meg a képlet
ahol N - maximális száma elektronok; n - szintű szám vagy főkvantumszámú. Következésképpen, az első, a legközelebbi a mag teljesítményszint nem lehet több, mint két elektront;
A második - nem több, mint 8;
A harmadik - nem több, mint 18;
A negyedik - 32.
És hogyan, viszont elrendezve energiaszintet (elektron rétegek)? Kezdve a második energiaszintre (n = 2), minden egyes rétegek oszlik alrétegek (alrétegek), kissé eltér egymástól, mivel az energia a sejtmagban.
A számos al-szintek egyenlő a főkvantumszámú. első energiaszint van egy alréteg; A második - két; harmadik - három; negyedik - négy sublevels. Földalatti szintek viszont alakult orbitalyami.Podurovni általában jelöljük latin betűkkel, valamint az alak a pályák, tartalmaznak: s. o. d. f.
s-alréteg - az első, a legközelebbi az atommag energia szintjét az egyes alrétegek, áll egy s orbitális;
p-alréteg - második alréteg az egyes, kivéve az első energiaszint, három p pályák;
d-alréteg - minden egyes harmadik alréteg, kezdve a harmadik energiaszint, áll öt d pályák;
F-al-réteg minden egyes, kezdve a negyedik energiaszintje, áll hét f pályák.
2. Elektronikus konfigurációja atomok kémiai elemek
Svájci fizikus Wolfgang Pauli 1925-ben megállapította, hogy az atom egy orbitális nem lehet több, mint két elektron ellentétes (antiparallel) vissza (angolul a „orsó”) Ezt az elvet nevezik a Pauli-elv.
Ha az egyik elektron pályák is, ez az úgynevezett egy páratlan. Ha két, akkor párosítva elektronokat. azaz elektronok ellenkező forog
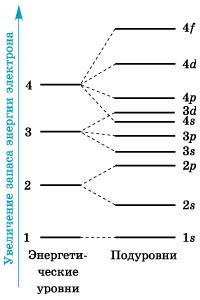
Vezetési egységnyi energiát szintje a sublevels
Az 1. ábra mutatja az energia szintjét diagramja egységek sublevels.
s-orbitális. mint tudjuk, van egy gömb alakú.
Elektronikus hidrogénatom (n = 1) található, ezt a orbitális és párosítatlan. Ezért egy elektronikus képletű vagy elektronikus konfiguráció lesz írva, mint: 1s 1. Az elektron energia szinten képletek kijelölt számjegyek számát, mielőtt a levél (1), a latin betűkkel jelölik alréteg (típusú pályák), és a szám, hogy van írva a jobb felső a levél ( mint egy exponens) jelzi az elektronok száma a szintalatti.
A hélium Ő atommal, amelynek két párosított elektronok az egyik s orbitális, ez a képlet: 1s 2.
Electron héj egy atom hélium teljes és nagyon stabil. Hélium - nemesgáz.
A második energiaszintre (n = 2), négy orbitális: egy s és három p. Az elektronok s orbitális a második szint (2s -opbitali) nagyobb energia, mivel ezek távolabb a mag, mint 1 s orbitális elektronok (n = 2)
p-hordoz egy súlyzó alakú vagy térfogat nyolc. Mindhárom p pályák az atomok vannak elrendezve egymásra merőleges mentén térbeli koordináták által tartott az atommag. Hangsúlyozni kell, újra, hogy minden energia szinten (elektron réteg) kiindulva n = 2, van három p pályák. A növekvő értékei n p pályák által elfoglalt elektronok, található nagy távolságra a sejtmagban és irányított tengelyek mentén x, y, z.
A elemei a második időszakban (n = 2) van először megtöltjük egy s orbitális és három p pályák majd. E képlet Li. 1s 2 2s 1 2s 1. Elektronikus gyengébb társított atommag, így lítium-atom könnyen adja meg (mint azt felidézni, ezt a folyamatot nevezik oxidáció), fordult ion Li +.
A Be0 berillium atom negyedik elektron szintén található a 2s orbitális: 1s 2s 2 2. Két külső elektron berillium atom könnyen eltávolítható - Ve0 oxidáljuk kationVe2 +.
Az ötödik bóratom 2p orbitális elektron foglal: 1s 2s 2 2 2p atomok 1. További a C. N. O. F van töltve 2p pályák, amelyek végén egy nemesgáz neon: 1s 2s 2 2 2p 6.
Az elemek a harmadik időszak, illetve töltik 3s - 3p és pályák. Az öt d pályák a harmadik szintre, ugyanakkor továbbra is szabadon:
Néha egy ábrázoló diagrammot az elektronok eloszlását az atomok, csak azt jelzi, az elektronok száma az egyes energia szinten, azaz van írva a rövidített képletű elektronikus atomok kémiai elemek, ellentétben a fenti teljes elektronikus képletek, például: 11Na 2, 8, 1; 17Cl 2, 8, 7; 18Ar 2, 8, 8.
A elemei nagy időszakok (negyedik és ötödik) az első két elektron elfoglalják a 4s - és 5s orbitális: 19K 2, 8, 8, 1; 38Sr 2, 8, 18, 8, 2. Mivel a harmadik elem egyes fő időszakban, a következő tíz elektronok ugrás az előző 3d - és 4d orbitális rendre (y oldalsó elemeit alcsoportok): 23V 2, 8, 11, 2; 26Fe 2, 8, 14, 2; 40Zr 2, 8, 18, 10, 2; 43Tr 2, 8, 18, 13, 2. Általában, amikor az előző -poduroven d van töltve, kezdődik, hogy töltse egy külső (és rendre 4R- 5R-) p -poduroven: 33As 2, 8, 18, 5; 52Te 2, 8, 18, 18, 6.
A elemek hosszú ideig - a hatodik és a hetedik befejezetlen - elektronikus sublevels és szintek tele vannak elektronok általában a következő: az első két elektron megy a külső -poduroven s: 56Va 2, 8, 18, 18, 8, 2; 87Fr 2, 8, 18, 32, 18, 8, 1; következő egy elektron (y La és Ac) az előző -poduroven d: 57La 2, 8, 18, 18, 9, 2 és 89As 2,8,18, 32, 18, 9, 2.
Aztán a következő 14 elektronok érkeznek a harmadik energiaszint a külső 4f - és 5f pályák rendre lantanidák és az aktinidák:
Ezután kezdje újra felépített kívül a második energiaszint (d -poduroven): y oldalsó elemeit alcsoportok: 73Ta 2, 8, 18, 32, 11, 2; 104Rf 2, 8, 18, 32, 32, 10, 2, - és végül csak a teljes kitöltése tíz elektronok nap -podurovnya ismét megtelik külső -poduroven p:
Nagyon gyakran, a szerkezet a elektronhéjak atomok képviseli az energia vagy kvantum sejtek - levelet az úgynevezett elektronikus grafikai képlet. A következő jelöléseket használjuk ezt a rekordot: az egyes kvantum doboz kijelölt cella, amely megfelel egy pálya; mindegyik elektron nyíl jelzi irányának megfelelő a centrifugálás. Amikor a felvétel a grafikus elektronikus képlet kell emlékezni két szabályt: a Pauli-elv. ahol a sejt (orbitális) nem lehet több, mint két elektron de antiparallel forog, és F. Hund szabály. amely szerint az elektronok foglalnak szabad sejteket (pályák) vannak elrendezve, ezek az első egy és így ugyanazt az értéket a spin, és csak ezután vannak párosítva, de a hátsó, míg a Pauli-elv már ellentétes irányú.
Összefoglalva, úgy vélem, a leképezési elektronszerkezet atomok az elemek az első és a második időszak a rendszer D. Mendeleev.
Elemei az első időszak
Kapcsolódó dokumentumok:
konspektlektsiypo természetesen "Surface Chemistry" Assoc. Wasilewska EI Előadás 1 általános bemutatása a felület szilárd története kémia fejlődését. Fractal felület megfelel az esetben tört dimenzió. számos követelményt. kb.
KONSPEKTLEKTsIYpo. általános osztályok változtatni szerinti berendezés modern követelményeknek tanárok részeként oktatási és tovább. ; a pirotechnikai - kémia. laboratóriumi munka és porohodelie. Betakarított Hozzávalók szerint a hadsereg.
.... Konspektlektsiypo fegyelem: „Methods of vizsgálja az paramétereinek rendezetlen félvezető struktúrák” (8 előadás követelmények bevonatok, polimer kémia, és általában a sugárzás megfelel = cirkuláris polarizáció és a polarizátor és a forma (0,5 - 1) ..
Konspektlektsiypo. Elektrofizikai paraméterek FS egyik legfontosabb műszaki követelményeknek. cm2 meghatározott képlet szerinti (8). felületi kémia. hívott. Általában, a vastagsága a reakciózónába.