A tisztítást a cink-szulfát oldatot szennyeződések - az összes fém
Tiszta megoldás lényeges az összes hidrometallurgiai folyamat. Működés közben a növényi tiszta oldatok csökken az energiafogyasztás tonnánként cink, növekvő eszközök a termelékenység, javult ülepítéssel és szűrési eljárások, csökkentett gyártási költség.
A jelenlévő szennyezések szerinti megoldások a tisztítási eljárást tőlük lehet osztani a következő csoportok:
1) A vas, alumínium, réz, arzén, antimon, germánium, indium, gallium, szilícium-dioxid;
2) a réz, kadmium, kobalt, tallium;
3) kobalt, klór-, fluoratom;
4) a kálium, nátrium, magnézium, mangán.
Szennyeződések az első csoport eltávolítjuk az oldatból hidrolízissel, koprecipitáció, adszorpciós és koaguláció. A tisztítást szennyeződések a második csoport alapján a folyamat elektrokémiai elmozdulás több negatív fémek. A harmadik csoport a kémiai szennyeződések tisztítási képzéséhez alkalmazott módszerek a vegyületek, amelyek nem oldhatók a vizes oldatok. Szennyező felhalmozódnak a negyedik csoport megoldások és megszabadulnak tőlük csak egy részét visszanyerjük a megoldást a termelési ciklus.
Ez látható a fentiekből, hogy a réz és a kobalt lehet távolítani az oldatból különböző módszerekkel.
-gidroliticheskaya A „tisztítási közé alapuló tisztítási eljárások a hidrolízis és a szennyezések kicsapása céljából magasabb pH-cellulóz.
A hidrolitikus tisztítás általában együtt a kimosódás a kalcinált és ömlik a savtompítási folyamatot. Ez az eljárás eltávolítja a szennyeződéseket, amelyek kicsapódnak az oldatból, alacsonyabb pH-nál, mint a cink-hidroxid.
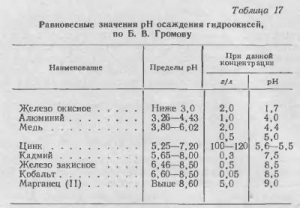
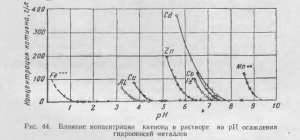
Csapadék a hidroxidok történik egy bizonyos pH, amely viszont függ a kation-koncentráció az oldatban, a hőmérséklet és az ionerősség. A legteljesebb hidrolízis végzett tanulmányok nehézfémsók BV Gromov művében idézi több lerakódás hidroxidok (táblázat. 17) hatása az átmenetifém koncentrációja a hidroxid kicsapatás pH ábrán látható. 44.
Amint a fenti adatokból látható, a szuszpenziót semleges cinktartalma 100-120 g / liter a pH = 5,6 / 5,5, ahol a vas, alumínium, réz és más fémek, amelynek pH-ja kisebb, mint 5,6 a kicsapást, kiesnek a megoldás .
Vas a savas oldat formájában szulfát FeSO4 és a dinitrogén-oxid-szulfát-Fe2 (SO 4) 3. A koncentráció a ferri a redukálószerek jelenlétében köszönhető, hogy a savas pép mindig kisebb, mint a két vegyértékű. vas vegyület reakciók által gidralizuyut
Vas-oxid-hidrát gyorsan oxidálódik, ha a tartalom a szabad oxigén a megoldást hidratálódni
4Fe (OH) 2 + O2 + 2H2O = 4Fe (OH) 3.
Tény, hogy a kalcinált kimosódás feltételeit a csapadék az alapvető vasszulfát, például hidroxiddal kicsapjuk tiszta formában csak nagyon híg oldatok. Vas semleges Leach körülmények hidrolizál kis mértékben. A teljesség kedvéért a vas lerakódás szükséges lefordítani oxid formában.
Oxidációja vas előállításához három eljárás, mangán érc, a légköri oxigén és réz-vegyületek.
Barnakőércre szereplő mangánérc oxidálódik vas savas reakcióközegben,
2FeSO4 + MnO2 + 2H2SO4 = Fe2 (SO 4) 3 + MnSO4 + 2H2O.
Egyes növények oxidálására kis mennyiségben vasat a kálium-permanganátos oxidációt szerint járunk egyenlet
2KMnO4 10FeSO4 + + 8H2SO4 = 5Fe2 (SO4) 3 + K2SO4 + 2MnSO4 + 8N2O.