Az ionizációs potenciál - kémiai enciklopédia - Enciklopédia és Szótár
részecske (molekula, atom, ion), a minimális potenciális különbség U-Rui át kell mennie egy elektron gyorsuló elektromos. mező megszerezni kinetikus. elég energiát, hogy ionizálja a részecskéket. P. és. X részecskék alkotnak X „részecske megfelel a folyamat:
Az általánosabb fogalom-ionizációs energia E, min. a szükséges energia egy elektront távolítanak el a részecskék a végtelenig. Ez kapcsolódik az AP és. kapcsolat:
ahol e az elemi elektromos. díjat. Az ionizációs energia kötődését CMV részecskéket, és nem függ a módszer eltávolítása egy elektron, míg a P. és. szigorúan véve, csak az első történelmileg jellemző elektron impakt ionizációs eljárással (lásd. ionok Gázok) .Energiya ionizációs kifejezve eV, numerikusan egybeesik P. és. kifejezett V.
Megkülönböztetni az első, második, és így tovább. G. P. &. a megfelelő ártalmatlanítása a részecskék az első, második és így tovább. g. elektronok. És a második AP. semleges részecskék X egybeesik az első AP és. X + ion és t. D., És P. Origin. otritsat. ion X - egybeesik a elektron-affinitása a részecske X.
A koncepció atomok az első, második, és a t. D., és p .. említett ionizációs a gerjesztett atom alkotnak egy gerjesztett fel. ion. Hogy megkülönböztessük molekulák adiabatikus P. és. és függőleges és az AP. Adiabatikus P. és. Ez megfelel egy olyan folyamatnak a K-készlet molekulák az alapállapotú, ami a ionizáció fel. mondják. iont az alapállapot. Függőleges P. és. azzal jellemezve, az ionizációs a molekulák egy raj képződött Pier. nahoditya ion önkényesen energetich. állapot (rezgési és elektronikus), és a megfelelő kvantum átmenetek zajlanak megváltoztatása nélkül atomközi távolságok (ábra. 1).
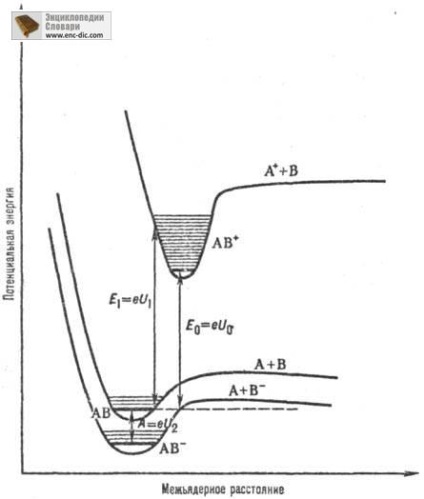
Ábra. 1. Curves potenciát. energia alapvető elektronikus a molekulák, ionok AB + AB és AB -. U0 - adiabats első ionizációs potenciálja a molekula AB (E0 energiája ionizáció); U1- első függőleges ionizációs potenciálja a molekula AB (E 1 megfelelő ionizációs energia), A-adiabatikus görbét Teach. az elektron affinitása a molekula AB (U2 -adiabatich ionizációs potenciálja ion AB -.).
Talán termodinamikai. P. és meghatározása. atomok és adiabatikus P. és. molekulák szabványos entalpiája DH 0 p-TION XX + e abs. nulla T-ry:
NA Avogadro, ahol egy állandó.
Először P. és. Ismeretes az atomok valamennyi elemének perio-árokba. rendszer és a nssk. ezer. molekulákat. Fényében atomból egy nukleáris töltés Z <10-15, как правило, надежно определены все П. и. (первый, второй и т. д. до Z); у более тяжелых атомов-неск. начальных П. и. В изменении первых П. и. атомов явно выражена периодичность при увеличении Z. При движении слева направо по периоду П. и. вообще говоря, постепенно увеличивается; при увеличении Z в пределах подгруппы П. и. уменьшается (рис. 2).
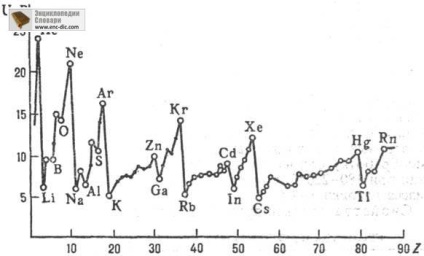
Ábra. 2. függőség Első ionizációs potenciál U1-atomot tartalmaznak, Chem. elemei a atomszámú Z.
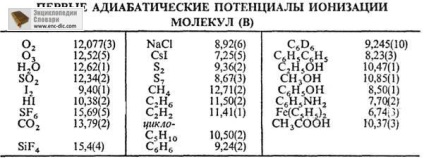
DOS. Sovr. eljárások annak meghatározására, PI és. fotoelektron spektroszkópiával, fotoionizációs, a tanulmány a ion-molekula reakciók, felületi ionizációval. A legjobb meghatározásának pontossága P. és. atomok és molekulák legegyszerűbb elért spektroszkópiai. konvergenciájának spektrális vonalak adatsor. A komplex molekulák előnyösen fotoelektron spektroszkópiával (elérhető pontossággal, hogy b0,001 eV). Ugyanakkor nem szabad elfelejteni, hogy ez a módszer általában értékeit adja meg a függőleges helyett az adiabatikus és PP. P. és. atomok és atomos ionok befolyásolja, amellett, hogy a Z, az árnyékoló hatása az alapul szolgáló elektronikus szinteket. Minimum első AP. az alkálifémek: Cs 2893 A, Li 5390 V; maximum - nemesgázok: Nincs 24,580, Rn 10745 B. Ismert P. és. molekula egy értéke 5 és 20 V (lásd. táblázat.).
A con. 70-es. 20. talált t. nevezett. superschelochi molekulák rendkívül alacsony értékeket AP és. OK 4 (3,62 B) 3 OK (3,65 V), ClNa2 (4,15 V), és mások.
Az átmenet a vegyérték-elektron egy atom a P. és feszít®fája. meredeken emelkedik. Így Legyen U1 9320 V,