Az ipari termelés az alkohol biológiai anyagból
A modern ipari technológia etanol előállítására nyers élelmiszerek az alábbi lépéseket tartalmazza:
§ előállítása és finomítása a keményítőtartalmú nyersanyag - gabona (többnyire - rozs, búza), burgonya, kukorica, stb ...
§ Az erjesztés. Ebben a szakaszban keményítő enzimes lebomlása során fermentálható cukrokká. Ezekre a célokra használt rekombináns készítmények alfa-amiláz által termelt biomérnöki úton előállított - glyukamilaza, Amilosubtilin.
§ Az erjesztés. Köszönhetően élesztő cukrok fermentációjával alkoholban egy felhalmozódása a Braga.
§ bragorektifikatcii. Ez végzett a gyorsulás oszlopokat.
Hulladék fermentációs gyártásából a szén-dioxid, Bard, éter-aldehid frakció, kozmaolaj és kozmaolajat.
Az előadás a modern lepárló mintegy 30 000-100 000 liter alkoholt naponta.
Az ipari léptékű etanolban készített tartalmazó nyersanyagokból cellulózt (fa, szalma), amelyet előzőleg hidrolizáljuk. A kapott elegyet a pentózok és hexózok, vetjük alá alkoholos fermentációt. Nyugat-Európában és Amerikában, ez a technológia nem volt elterjedt, de a Szovjetunióban (ma Oroszország) volt a fejlett ipar takarmány élesztő és a képződött hidrolízis etanolt.
Az iparban, amellett, hogy az első módszer, alkalmazásával etilén hidratálást. A hidratálás végezhetjük két rendszeren keresztül:
§ közvetlen hidratálást hőmérsékleten 300 ° C, a, 7 MPa nyomáson, katalizátorként ortofoszforsavat használunk, lerakódik a szilikagél, aktív szén vagy az azbeszt:
§ hidratálási lépésben közbenső terméken keresztül kénsav-észter, majd a hidrolízis (hőmérsékleten 80-90 ° C, a nyomás pedig 3,5 MPa):
Ezt a reakciót bonyolítja a kialakulását dietil-éterrel.
Etanol által termelt hidratációja etilén, vagy fermentációs, egy víz-alkohol elegy szennyeződéseket tartalmazó. Annak ipari, élelmiszeripari és gyógyszerkönyvben kérelmet le kell tisztítani. Frakcionált desztillációval biztosít etanol koncentrációja körülbelül 95,6% (tömeg).; Ez azeotrop desztilláció elválaszthatatlan elegy 4,4% vizet (tömeg.), És van egy forráspontja 78,15 ° C-on
Desztillációja etanol mindkét kibocsátások illékony és nehéz frakciók a szerves anyagok (fenék).
Abszolút alkohollal - etanol lényegében mentes vizet. Ez hőmérsékleten forr a 78,39 ° C, míg a finomított alkoholt tartalmazó nem kevesebb, mint 4,43% a víz forrni kezd pri78,15 ° C Desztillálásával nyert vizes alkoholt tartalmazó benzolt és egyéb módszerekkel.
Megjelenés: normál körülmények között színtelen illékony folyadék, jellegzetes szagú és égő ízét. Etil-alkohol könnyebb, mint a víz. Van egy jó oldószert más szerves veschestv.Sleduet elkerülése népszerű hibák: gyakran vegyes tulajdon 95,57% alkohol és az abszolút. Tulajdonságaik majdnem ugyanaz, de az értékek kezdenek eltérőek, kezdve 3-4-én tizedes pontossággal.
Reagál alkáli fémekkel alkotnak ethylates (vagy általános esetben - alkoholátok) és a hidrogén.
Reagál karbonsavakkal, észtereket képezve:
Csatlakozott dehidratálási reakció a kénsav jelenlétében (120 ° C), így dietil-éter:
Burns levegőn, illetve oxigénben hőt termelnek:
Hidridek és alkáli-hidroxidok, így ethylates:
Gidrogalogenirovaniya lép reakciót cink-klorid jelenlétében:
Etanol lehet használni üzemanyagként t h rakétamotorokban (például etanol üzemanyagként használt a világ első soros ballisztikus rakéta - Német „V-2”) .., belső égésű motor a tiszta formában. Miatt korlátozott higroszkóposság (lereped) használunk egy keveréket hagyományos cseppfolyós tüzelőanyagok. Előállításához használt kiváló minőségű üzemanyag és a benzin alkatrészek - Etil-terc-butil-éter, egy nem-fosszilis szerves, mint az MTBE.
§ a nyersanyag sok kémiai vegyületek, így például az acetaldehid, dietil-éter, tetraetil, ecetsavat, kloroformot, etil-acetát, etilén, stb.;
§ széles körben használják oldószerként (a festékiparban, a termelés a háztartási vegyszerek, valamint számos más területen);
§ egy komponense fagyálló és alátét;
§ háztartási etanolt alkalmazunk tisztítószerek és mosószerek, különösen a gondozási az üveg és a berendezési tárgyak. Oldószere a riasztó.
§ a kereset etil-alkohol lehet tulajdonítani antiszeptikumok;
§ mind fertőtlenítésre, mind podsushivayuschee jelenti külsőleg;
§ podsushivayuschee és barnító tulajdonságok 96% etil-alkohol használható a feldolgozási művelet mező, vagy egyes feldolgozási technikák sebész kezén;
§ oldószer gyógyszerek előállítására infúziók, növényi kivonatok, stb.;
§ tartósítószer tinktúrák és kivonatok (a minimális koncentrációja 18%);
§ habzásgátló hatóanyag együtt oxigénatom, a gépi lélegeztetés;
§ forró borogatást;
§ fizikai hűtés lázzal (dörzsölte) [3];
§ komponens az általános érzéstelenítés olyan helyzetben gyógyszerek hiánya;
§, mint egy habzásgátlószert tüdőödéma formájában inhalációs oldat 33%;
§ etanol ellenszere mérgezés egyes toxikus alkoholok, például metanol és etilén-glikol. Hatása annak a ténynek köszönhető, hogy a fermentalkogoldegidrogenaza, amikor több szubsztrátok (például metanol és etanol) hordoz egy versenyképes oxidációs, miáltal után időben (szinte azonnali, majd metanol / etilén-glikol) etanollal órás csökkenti a jelenlegi koncentrációja toxikus metabolitok (metanol - formaldehid és a hangyasav, etilén-glikol - oxálsav) [4].
Parfümök és kozmetikumok
Van egy univerzális oldószer különféle anyagok és a fő összetevője a parfümök, colognes, aeroszolok és m. P. része különböző eszközökkel, beleértve még például fogpaszták, samponok, zuhanyzó és hasonlók. D.
Az oldószert az élelmiszer ízek. Ezt fel lehet használni, mint tartósítószer pékárukat, valamint az édességek. [6]
Bejegyzett mint élelmiszer-adalékanyag E1510 [7].
Energia értéke etanol - 7,1 kcal / g.
Formaldehid (a latin formájában # 299; ca «ant.") - színtelen gáz egy éles szag, oldódik vízben, alkoholokban és poláris oldószerekben. Irritáló, toxikus.
Formaldehid - egy első tagja a homológ sor az alifás aldehidek, aldehid hangyasav.
Az alacsony elektron sűrűség a szénatomon formaldehid könnyen reagál még gyenge nukleofil. Ez, különösen annak a ténynek köszönhető, hogy a vizes oldatban a formaldehid hidratált formában.
Formaldehid belép az összes reakciót jellemző alifás aldehidek. Különösen reakciók nukleofilekkel és redukáló szerekkel.
A főbb ipari eljárás formaldehid előállítására - a metanol oxidációjához:
Oxidációja a metanol formaldehiddé alkalmazásával végezzük egy ezüst katalizátor hőmérsékleten 650 ° C-on és légköri nyomáson. Ez a folyamat jól elsajátította, és 80% -os formaldehid-t ezzel a módszerrel kapott. A közelmúltban kidolgozott ígéretesebb módszer azon alapul, a vas-molibdén katalizátorok. Ha ezt a reakciót 300 ° C-on Mindkét folyamat, a konverzió 99% [1].
A folyamat a dehidrogénezési metanol végre egy cink-réz-katalizátorok 600 ° C-on, még nem kapott széles körű fejlődését, azonban ez nagyon ígéretes, mivel ez lehetővé teszi a formaldehidet nem tartalmazott vizet.
Van is egy ipari eljárás formaldehid előállítására oxidálásával metán:
Az eljárást végezzük hőmérsékleten 450 ° C, a nyomás pedig 1-2 MPa, a katalizátort alkalmazunk alumínium-foszfát AIPO4.
Biztonsági és mérgező tulajdonságokkal
A formaldehidet a szervezetben termelődő oxidációjával metanolt.
Mérgező, ez hátrányosan befolyásolja a genetikai anyag, a reproduktív szervek, légutak, a szem, a bőr. Ez egy erős hatással van a központi idegrendszerre.
Maximális megengedhető koncentrációt (MPC) formaldehid: [2] [3] [4]
§ MPCwa = 0,5 mg / m³
§ PDKm.r. = 0,035 mg / m³
§ PDKs.s. = 0,003 mg / m³
Halálos dózis 35% -os vizes formaldehid-oldatot (formalin) 10-50 g
A vizes formaldehid-oldat - Formalin - okozza fehérjék denaturálása, ezért használják, mint egy cserzőanyag a bőr feldolgozás és barnító zselatinba proizvodstvekinofotoplonki. Mivel az erős hatása formaldehid barnító is egy erős fertőtlenítő, ez a tulajdonság a formalin használják a gyógyászatban, mint antiszeptikus (Formidron, Formagel és hasonló gyógyszerek), és a megőrzése a biológiai anyagok (létrehozása anatómiai és más drogok).
Az ömlesztett formaldehid megy gyártását polimerek, hőre keményedő (fenol-formaldehid, és a melamin-formaldehid gyanták karbamidformaldenidnye), ez is széles körben használják az ipari szerves szintézisben (pentaeritrit, trimetilol-propán stb).
Formaldehid jól oldódnak. a víz, alkoholok és mások. Polar p-celeration. Alacsony m-PAX minden arányban elegyedő apoláros p-erator: toluol, dietil-éter, etil-acetát, CHCI3 (növekvő T-ry p-rimost csepp) nem szol. petroléterben. Víz-p ry tartalmaz formaldehidet egyensúlyi keveréke monohidrátot CH2 (OH) 2 (99,9%), instabil svob. állami és polimergidratov HO (CH 2) n H (n = 2-8) fenntartható kristályos. vegyületek. Ha továbbra is. tárolására, vizes p-árok (különösen alacsony T-PAX), valamint azok koncentrációja mértékben polimerizatsiiuvelichivaetsya. A tárolási vizes formaldehid p-árok stabilizáltuk metanollal (lásd. Formalin). Bepárlásával a vizes p-árok vákuumban obrazuetsyaparaform vagy paraformalde útmutató (CH 2 O) n (n = 8-12), az intézkedés alapján alkálifém a konc. víz-R-ry -. ún. egy-polioximetilén (n> 100). A polimerizációt egy nem poláros p-erator vezet poliacetál (n> 1000).
Paraformaldehyde - bestsv. kristályok szaga formaldehid, m. pl. 120-170 0 C, hideg kerületi víz ryaetsya lassan forró -Quickly képező p-ry formaldehid rossz oldhatósága. aceton; gyúlékony, azaz. a GSP. 72 0 C.
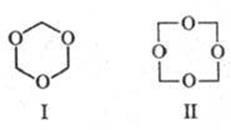
Ismert ciklikus. formaldehid polimerek: trioxán (.. f la I, olvadáspont: 64 0 C-on), desztillációjával kapott 60% -os vizes p-RA formaldehid híg. H2 SO4. és tetraoksimetilen (II képlet, m. Op. 112 0 C-on), kialakítva a melegítés során. diacetát Vysokomol. POM.
Formaldehid nagy a reaktivitása. H2 jelenlétében helyreáll. Sok fémek vagy fém-oxidok (például Ni, Pt, Cu.) Metanol; oxidált HNO3. KMnO4 a hangyasav-a Te vagy CO2-H2 O; kicsapódik tovább. fémek (Ag, Pt, Au, Bi, stb) p-nek ezek sói, ahol az oxidált, hogy hangyasav-tu.
Egy aldehiddel jelenlétében. erős lúgok formaldehid belép m. nevezett. p-CIÓ kereszt Cannizzaro (C6 H5 CHO + HCHO C6 H5 CH2 OH + HCOONa); acetaldehiddel jelenlétében. A Ca (OH) 2 formák pentaeritrit, a gőzfázisban 285 0 C - akrolein; az intézkedés alapján Mg vagy Al-alkoxidok formaldehidet megy diszproporcionálódása alkotnak Me-tilfomiata (lásd. Tishchenko reakció).
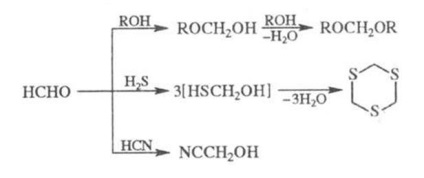
P-CIÓ formaldehid alkoholokkal jelenlétében. T-erős vezet acetál (formal), H2 S - ciklikus. tritianil- HCN jelenlétében. lúgok - ktsiangidrinu:
Formaldehid csatlakozik olefinek jelenlétében. savas katalizátorok, így 1,3-diglikol és 1,3-dioxán (lásd. Prins-reakció), p-CIÓ formaldehid izobutilénnel izoprén ad, a kondenzációs folyadék fázisú propilén jelenlétében. BF3 vagy H2 SO4 - butadién. Formaldehid és keténdietil a prom-sti kapnak b-propiolakton.
P-CIÓ formaldehid acetilén - Ind. Eljárás butadién (lásd. Reppe reakció), a kölcsönhatás. két molekula formaldehid atsetilenomobrazuetsya 2-butin-1,4-diol.
A pres. mész formaldehidet alakul át szénhidrátok:
A kölcsönhatást. formaldehid hexametiléntetraminnal képződött NH3, primer aminokkal - trimerek, másodlagos - bisz (di-alkil-amino) metánok:
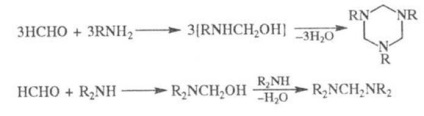
Conn. labilis hidrogént reagáltatunk formaldehiddel és NH3 (vagy aminok) a Mannich-reakció. P-CIÓ formaldehidnek NH4Cl Ind. Eljárás metil-amin: 2NSNO + NH4 Cl CH3 NH2 · HCl + HCOOH (p-TION mehet alkotnak di- és trimetil-amin). A karbamid-formaldehid lúgos körülmények között ad dimetilolnye mono- és származékaik a polikondenzációs ryh-készített karbamid-formaldehid gyanták, és izmelamina formaldegida- és melamin-formaldehid gyanták.
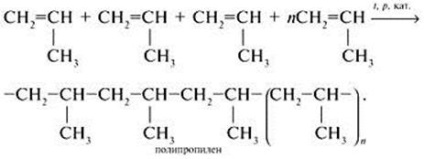
Propilén (propén) CH 2 = CH-CH 3 - telítetlen (telítetlen) szénhidrogén-sorozat etilén-éghető gáz. Drug narkotikus hatása erősebb, mint az etilén. Veszélyességi osztály - a negyedik. [1].
A propilén egy gáznemű anyag alacsony forráspontú fp = -47,7 ° C és olvadáspontja op = -187,6 ° C, az optikai sűrűség 4 d20 = 0,5193.
Ez jelentős reakcióképesség. Kémiai tulajdonságai határozzák meg a szén-szén kettős kötést tartalmaz. p-kötést, mint a legkevésbé tartós és olcsóbb, míg az intézkedés a reagens megtört, és a felszabadult vegyértéke szénatomot költenek összekötő atomok teszik ki a molekula reaktáns. Minden kapcsolási reakció folytassa a kettős kötés áll hasító π-alkén kommunikáció és oktatás a földön törés két új # 963; -kötéseken.
A leggyakoribb mellékhatások csatlakoznak az heterolitiku típus, amely elektrofil addíció.
Csatlakozási halogénatom (halogénezés)
A halogénezési reakciót általában valamely oldószerben, a szokásos hőmérsékleten. A halogének könnyen csatlakozik a helyén törés a kettős kötést alkotnak digalogenoproizvodnyh. Ez könnyebb kapcsolatot a klór és bróm, nehezebb - jódot. A fluor reagál robbanásszerűen.
] Csatlakozási hidrogénatom (hidrogénezési reakció)
Hidrogén hozzáadásával a katalizátorok jelenlétében (Pt, Pd, Ni), propén telítődik szénhidrogén - propán.
Vízcsatlakozás (hidratálási reakció)
Propilén reakcióba lép a vízzel alkotnak egy monoalkohol izopropanolt, ahol a kettős kötés ismertet.
Csatlakozási halogenidek (HHal)
Akkor következik be, Markovnyikov szabály. Hidrogén HHal savat csatlakozik a legtöbb hidrogénezett szén atom a kettős kötést. Ennek megfelelően Hal maradékot kötődik ahhoz a szénatomhoz, amelynél a minimális számú hidrogénatomok.

Példa gidrogalogenirovaniya - részesülő bróm-származék reakciójával HBr propán és propilén.
Lásd még :. Gidrogalogenirovanie alkének
Az égési levegő
Burns, amikor lángra levegőben: 2CH2 = CHCH3 + 9O2 → 6N2 + 6SO2 O.
Mivel az oxigén a levegőben, propilén gázzal robbanó keverékeket képez.
A semleges vagy gyengén lúgos vizes közegben propilén oxidáljuk kálium-permanganát, amely mellé elszíneződése és képződése KMnO4-oldatot glikolok (vegyületek a két hidroxilcsoport szomszédos szénatomhoz kapcsolódó). Ezt a reakciót nevezzük Wagner reakciót.
Reakciókörülmények: hő, katalizátorok jelenlétében. A vegyület molekula fordul elő hasításával intramolekuláris π-kötések, az újabb intermolekuláris és # 963; -cvyazey.