Az elmélet az égési folyamat - minden kohászati
Oxidálása szulfidok oxigén a levegőben - egy irreverzibilis exoterm reakció:
MeS + 1,5O2 = MeO + SO2.
Amikor levegőn hevítjük szulfidformává elér egy bizonyos hőmérsékleten a reakciósebesség válik olyan nagy, hogy az evolvált hő nem csak, hogy kompenzálja a hővesztesége, hogy a környezet elég, hanem, hogy a hőmérséklet oxidálható szulfid, ami tovább gyorsítja az oxidációs reakciót. Ta a hőmérséklet, amely felett az oxidációs folyamat folytatódhat függetlenül anélkül ellátó kívülről hőt, ez az úgynevezett gyulladási hőmérséklet-szulfid. Ez a hőmérséklet függ a fajta-szulfid, és szemcsemérete, és a szulfid nagyobb disszociációs nagyobb rugalmassága ez alacsonyabb, mint az alsó szulfidokat rugalmassága alacsony disszociációs.
A sebesség a oxidációja szulfid szilárd oxigén a levegőben által meghatározott feltételek gázok diffúziója révén a szűrőlepényt szilárd reakciótermékek, a bevonat még változatlan-szulfid egy központi része a gabona. Reakció áramlik határán a szilárd fázisok - egy fém-szulfidot és egy szilárd reakcióterméket - fém-oxid-réteg, amelyen keresztül az oxigén befelé diffundál, és a feléje - kén-dioxid. Mivel a sebesség előre-szulfid oxidációs reakció előtt lelassul, mivel a körülmények az oxigénellátás és a kén-dioxidot a kéreg megvastagszik fokozatosan romlani oxidok. A szükséges idő teljes oxidációja szulfid szemcsék erősen növekszik növekvő szemcseméret.
A hőmérséklet növelése egy határon túl sok esetben csökkenti az oxidációs ráta, ha a hőmérsékletet emeljük tömítés - szinterezés héja oxidok rontja diffúzió. A oxidációja vas-szulfid hőmérséklet fölé emelkedik 900 ° késlelteti oxidációval, mivel a fenti 900 ° van egy erős tömítést héj vas-oxidok.
Oxidációja szulfidok légköri oxigénnel egy fő reakció a szinterezési eljárások kénes anyagok azzal a céllal, részleges vagy teljes eltávolítása szulfid-ként tartalmaz. Jelenleg csak kitéve pörkölés finom szemcséjű porok. Flotációs koncentrátumok meglehetősen finomszemcsés gyors oxidációt; kompakt szulfid anyagok, mint Feinstein, finomra őrölt égetés előtt.
A régi módon a tüzelési oxidálni az oxigén a porréteg vastagsága 50-100 mm levegő feküdt a kandalló kemence. Mivel csak elegendően gyorsan oxidálódik réteget a részecske felületén, az anyagot peregrebaetsya speciális mechanizmus, és ezáltal a visszavonását a mélység a felületi réteg nem-oxidáló-szulfid részecskék, valamint a mozgó anyag előrehaladó áramot kohógázoknak. Pörkölés a kandalló lassú, nehézkes gépek és terméketlen. A teljes kén eltávolítása a nyersanyagból kell a kiégett fűtőelemek miatt a nagy hőveszteség.
Új intenzív oxidációs tüzelési folyamatot úgy hajtjuk végre, hogy minden egyes gabona nyersanyag Égetés közben a forró gázáram oxigént tartalmazó. Ez kedvező feltételeket teremt az oxigénellátást és eltávolítását SO2 keresztül torta szilárd szemcsék szulfid oxidációs termékek, és a folyamat maximális sebességgel.
A kiégetés alatt szuszpendálunk száraz szulfidot koncentrátumot atomizált levegő fúvóka az üregbe a kemence fűtött falai.
Amikor égetés egy fluidágyas izzó vastag (500-1000 mm) por égetett anyag a kandalló a kemence folyamatosan átöblítjük levegőt több apró lyukak 2 mm átmérőjű a kandalló. A fúvókák a levegő behatol a réteg égetett anyag, hozzon létre benne intenzív örvényszerű áramlás közlésével réteget típusú forrásban lévő folyadékot. Friss koncentrátumot folyamatosan tápláljuk be a fluid ágyba, és a kalcinált terméket a folyamatosan át a kemencén keresztül küszöböt, korlátozza a magassága a fluid ágy.
Intenzív égetési technikák nyersanyagok magas kéntartalmú, amelyek nem igényelnek harmadik fél üzemanyag és termel SO2 gazdag gázok. Sok a termék ezen kalcinálással körülmények között, magával vitt gázok formájában por, amelyre elfog kiváló por eltávolító rendszer használható.
Kalcinálása ólom-szulfid anyagok fölös levegővel úgy, hogy a pörkölés gáz terméket tartalmaz, valamint a SO2 és N2, jelentős mennyiségű oxigénnel. Az oxigén oxidálja SO2, hogy kén-trioxid reakciójával SO2 + 1 / 2O2 = SO3. Ez a reakció az alapja a kénsavas kontakt eljárás. A egyensúlyi állandó a disszociációs reakció kénsavanhidridnek
meghatározni nagy pontossággal.
KSO2 számértékek az alábbiak:
Ezek az értékek azt jelzik, KSO2 SO3 alacsony szilárdságú magas hőmérsékleteken. Szerint Chatelier szabály SO3 disszociáció csökkenésével növekszik nyomást. Ez alapvető fontosságú az égési folyamat, ahol az SO3 parciális nyomása a kemence gázok nem magasabb, mint 0,1 atm.
SO3 erősen gátolja szintézis reakciót alacsony hőmérsékleten. A platina katalizátor előállítására kénsav képződését okozza SO3 400 °, Fe2O3 katalitikusan hatékony fellépés át 600 °.
A kompozíció a kemence gázokat tüzelési szulfidok a hőmérséklettől függően változik, mivel a kialakulását és bomlását SO3. Ha a gázt, hogy a tetején a formáció volt SO3 SO2 és O2 parciális nyomása rendre PSO3 és PO2, majd képződése miatt SO3 nyomás PSO3 SO2 és O2 parciális nyomása csökken. Válnak egyenlő pSO2 = PSO3 - pSO3. és a PO2 = PO2 - 1 / 2pSO3, mivel a kialakulása SO3 mol fordított mol SO2 és fél mól O2. Az egyensúlyi rendszer nyomása SO2, SO3 és O2 kapcsolódnak az expressziós KSO3, amely lehetővé teszi, hogy kiszámítja a SO3 gáznyomást a kemence (pSO3) PG oldat a következő egyenlet vonatkozásában pSO3.
A jelenléte SO3 a pörkölő gázokkal égetés során képződését okozza szulfidok szulfátok a fém-oxidok.
A kapott szulfátok egészen stabilak, oxidáló atmoszférában, és tudja mozgatni a végső gyertya. Bizonyos esetekben kívánatos, ha a cél az, teljes eltávolítása pörkölés kén, más esetekben - az égetés során a későbbi hidrometallurgiai kezelés - a kialakulását szulfátok hasznos. A kérdés a feltételek kialakulása és bomlása szulfát égetés során meg lehet oldani, ha vannak termodinamikai jellemzők szulfátok.
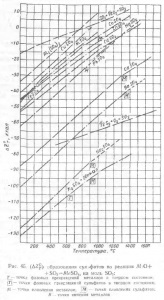
A jellemző mennyiség szolgálhat-szulfát (# 916; Z0T) kép-szulfát fém-oxid és kén-trioxid reakció szerint
(Oxid) vez + (SO3) gáz = (-szulfát), aromás,
említett egy mol SO3 töltött.
Ábra. 45 ábrázoltuk a hőmérsékletfüggését (# 916; Z0T) kép különböző szulfátok görbék (# 916; Z0T) kép SO2 és SO3 1 mól a reakcióterméket.
Egyenlet szulfát képződéséhez vezető reakció határozza meg az alakját expressziós disszociációs egyensúlyi állandója a reakció Ksulf-szulfát. = PSO2 érték (# 916; Z0T) szulfo - a számértéke ez az állandó:
Érték (# 916; Z0T) Ksulf szulfit és jellemzése kémiai kötés erőssége az oxiddal SO3 - szilárdság-szulfát. Minél nagyobb az értéke ezeknek a mennyiségek, a kisebb szilárdságú-szulfát.
Figyelembe véve a grafikonok (ábra. 45), meg kell jegyezni, hogy az erőt a-szulfát növekszik alapvető tulajdonságait az oxidképző-szulfát. A legstabilabb forma szulfátok, alkálifém-oxidok, szulfátok, oxidok kevésbé erős kalcium és bárium-szulfátok még kevésbé tartós kétértékű nehézfémek és a leginkább instabilak szulfátok kialakítva Al2Oz amfoter oxidok, Fe2O3.
A tulajdonságai és összetétele-szulfát kohógázoknak tudja megoldani a problémát a lehetősége vagy lehetetlen kialakítani-szulfát, valamint megoldani a problémát a disszociációs jelenlétében vegyületek disszociációs termékek. A formáció szulfát lehetséges, ha nagynyomású gáz SO3-szulfát hasítási terméket tartalmazó atmoszférában kohógázoknak fölött az oxid nagyobb vagy egyenlő, SO3 során kialakult nyomást disszociációs-szulfát.
Szulfát képződik, ha (pSO3) PG> (rSO3) szulfit, különben lehetetlen, hogy szulfát képződését, és a már kialakult-szulfát kell lebomlanak.
Gyakorlati tüzelési találtuk, hogy a kialakulását szulfátok által kedvelt magas SO2-tartalmának a kalcinálást és az alacsony hőmérsékletű termékek. szulfátok képződése égetés során figyelhető hőmérsékleten 500-650 °.
Amikor égetés lehetetlen elkerülni a kialakulását szulfátok, meghatározott az égő lépés lenne kedvező feltételeket szulfatálás. Ha a kalcinálási terméket nem lehet a kén, az előzőleg alakított szulfátok kell tönkre hőmérséklet növelésével. Ha az égetési hőmérsékletet növeljük úgy, hogy (pSO3) PG kisebb lesz (rSO3) szulfocsoport, továbbá-szulfát képződése megszűnik, valamint a már kialakult-szulfát bomlik lassan fejlődése mellett SO3. szükséges, hogy a hőmérséklet olyan gyors és teljes megsemmisítése a szulfát, hogy a nyomás a gáz-halmazállapotú disszociációs termékek-szulfát meghaladja a külső nyomást.
Disszociációja-szulfát az oxid és SO3 kíséri jelentős disszociációja SO2 és SO3 a oxigén disszociációs folyamat, és leírása a következő reakcióegyenlet:
és a nyomás a reakciótermékek áll egy nyomás SO3, SO2 és O2:
Méret = Ksulf rSO3 ad csak az egyik komponens Rsulf - nyomás SO3. Hőmérsékleteken észrevehető bomlás tartós szulfátok pSO3 nagysága komponens csak kis hosszú teljes nyomás a reakció termékek már erősen disszociált SO3 SO2 és O2.
Nyomás disszociációs termékek-szulfát SO3, SO2 és O2 összekapcsolt expressziós KSO3, és SO2 és O2 nyomás - aránya pO 2 = 1 / 2pSO2, mivel ezek a gázok ki vannak kapcsolva SO3 bomlik. A mennyiségek Ksulf KSO3 és egy bizonyos hőmérséklet és a fenti kapcsolatok közötti mennyiségek pSO3, pSO2 és a PO2, lehet számítani a teljes gáznyomás nagyságrendű disszociációs általános képletű szulfát-
A hőmérséklet, amelynél Rsulf eléri 1 atm úgynevezett szulfát bomlási hőmérséklete. Fűtés kalcináljuk - kalcináljuk, hogy ezen a hőmérsékleten lehetővé teszi a gyors és teljes bomlás a korábban képződött szulfátot.
A mennyiség Psulf könnyen meghatározható kísérletesen közvetlen nyomás mérés-szulfát disszociációs termékek. A nagysága és mérete Rsulf KSO3 tudja számítani a parciális nyomása SO3, SO2 és O2, m. E. megtalálható a kísérleti adatok disszociációs konstanst Ksulf-szulfát. Sok szulfátok a kísérleti adatokat hőmérsékletfüggése a Rsulf.
szulfát elbomlási hőmérséklete jóval a hőmérséklet, amelynél szulfát- pSO3 érték disszociációs eléri 1 atm. A grafikonok (45. ábra). A legnagyobb pSO3 = 1 atm megfelel a hőmérséklet, amelyen (# 916; Z0T) -szulfát kép nulla. Például, (# 916; Z0T) image CdSO4 nulla 1440 °, és -PCdSO4 = 1 atm 1,060 °; (# 916; Z0T) image NiSO4 nulla 1050 °, és PNiSO4 = 1 atm 890 °. Ezért van szükség, hogy bele-szulfát SO3 disszociációja viselkedés számítások; nem tartása ez a feltétel eredmények nagy meghatározásánál hibákat szulfát bomlási hőmérséklet, a nagyobb, annál magasabb a szilárdság, a szulfát felett szárítjuk.
szulfát bomlási hőmérséklet csökken, ha-szulfát elbontjuk jelenlétében egy nem felejtő savas oxid engedélyezéséről szilárd oxid vegyületet egy fém-szulfát. Például, a szilícium-dioxid jelenléte a kalcium-szulfát bomlik reakciójával
CaSO 4 + SiO2 = CaSiO3 + SO3.
Ilyen körülmények között (# 916; Z0T) CaSO 4 bomlási reakciók részvételével ZSiO2 kevesebb (# 916; Z0T) CaSO 4 bomlási reakció nélkül SiO2 részvétele mennyiségben (D2 °) reakciót CaSiOs szétbontás CaO és SiO2. Ebből következik, hogy a kereset a ZSiO2 számára disszociáló SO3 CaSO 4 kíséri megnövekedett nyomás, és ebből következően, a hőmérsékletet csökkentjük,-szulfát bomlása.
Amikor bővítése alacsonyabb oxidok fém-szulfátok, továbbá képező felső-oxid, szulfát bomlási reakciót bonyolítja oxidációja az alsó fém-oxid. Például, a bomlási reakció 2FeSO4 = Fe2O3 + SO3 + SO2 kíséri az oxidációs Fe2O3 a FeO.
Tartós ezüst-szulfát Ag2SO4 disszociál a következő reakció szerint Ag2SO4 = 2Ag + SO3 + 1 / 2O2 egyidejű bomlás instabil oxid Ag2O komponensek ezüst.
Ezekben az esetekben az értéket (# 916; Z0T) reakció nem esik egybe (# 916; Z0T) szulfát képre, és úgy kell kialakítani, a támogatás a termodinamikai függvények jellemzésére az új eljárással előállított termékek.
Természetesen, az ismertetett esetekben bonyolult reakciók bomlási szulfátok kiszámításához mennyiségben Rsulf-szulfát, és a bomlási hőmérséklete kell vizsgálni a disszociációs SO3 a SO2 és O2.
Között képződött szulfátok és szulfidok változatlanul lehetséges mellékreakció a szulfid oxidációja oxigénnel szulfátok, például ZnS + 3ZnSO4 = 4ZnO + 4SO2, és képződése fémet, például PBS + PbSO4 = 2Rb + 2SO2.
Amikor a redukció a szulfátok gáznemű és szilárd redukálószerek állíthatjuk elő a különböző termékek típusától függően szulfát és a hőmérséklet. Tartós szulfátok Na2SO4, CaSO 4, BaSO4 alatt lassú hasznosítás megtartja az összes kén-fordulva szulfidok reakciójával CaSO4 + 4CO = CaS + 4SO.
A bomlása kémiai vegyületek teljes eltávolítását az illékony komponensek a feladata az egyik típusú folyamatban kalcinálás kalcinálás, mellyel a CaO mészkő, MgO a magnezit, Al2O3 alumínium-oxid alumínium-hidroxid, és így tovább. N. kemencék kalcináljuk az anyagot felmelegítik a gyors bomlási hőmérséklete megfelelő vegyületek: karbonátok, hidrátok, majd kalcináljuk a terméket lehűtjük.
Lebomlás vegyületek (karbonát-hidrát) áramban a kemence gázok lehetséges, ha a nyomás a gáz-halmazállapotú hasítási terméket vegyületet (CO2, H2O) nagyobb lesz, mint a parciális nyomása azonos terméket a kemencében gázok. Azonban, amíg a nyomás továbbra is disszociációs vegyületet termék kevesebb, mint a teljes nyomás a kemence atmoszférájának, disszociációs ráta alacsony, és függ a diffúziós feltételek disszociációs termékek a légkörbe a kemence gázok. Amikor melegítjük olyan hőmérsékletre, amelyen a nyomás a gáz-halmazállapotú disszociációs termékek egyenlő vagy nagyobb, mint az a nyomás a kemence atmoszférájának, a folyamat sebesség nem függ diffúziós tényezők és határozza csak a hőbevitel kívánt sebessége az endoterm disszociációs a vegyület.
A hőmérséklet, amelynél a gáz halmazállapotú vegyület disszociációs termékek nyomás eléri 1 atm, úgynevezett bomlási hőmérséklete a vegyület. Ellentétben a karbonátok és szulfátok hidrát hasítási termék csaknem teljes egészében CO2 vagy H2O, mivel ezek a stabil vegyületek észrevehetően nem dissitsiruyut annak összetevői közötti hőmérsékleten kalcináljuk.
A gyakorlatban, tüzelési végezzük az izzítási tengelyt és reverberatory kemencék, t. E. Atmoszférikus nyomáson. A kalcinálási hőmérséklet felett kell lennie a bomlási hőmérséklete a megfelelő vegyületek - karbonát vagy -hidroxid.
Ilyen körülmények, a kalcinálás lehet alávetni darabos anyag. Folyamat időtartama elegendőnek kell lennie ahhoz, hogy a hő a teljes tömege a darab egészen a bomlási hőmérséklete a megfelelő vegyületek.