Hogyan számoljuk a százalékos termelést in Chemistry
3 rész: meghatározása az elméleti hozam korlátozó reagentaRaschet produktaRaschet kitermelési százalék
A kémiában, a reakció hozama említett termék mennyiségét, amelyet úgy kaptunk, miután a kémiai reakció. Elméleti termelés - ez a maximális kapott termék maximálisan hatékony reakciót. A valóságban a legtöbb a reakciók nem olyan hatékony, mint a lehető - a tényleges hozam a reakció gyakran lényegesen kisebb, mint az elméleti hozam. Ahhoz, hogy kifejezze a hatékonysága a reakció, kiszámítja a százalékos hozammal. ezzel a képlettel:% kitermelés = (tényleges hozama / elméleti kitermelés) x 100.
1. rész 3: meghatározása határ-reagens
- 1. Indítsa el a felvételt a kiegyensúlyozott kémiai egyenlet. Ez segít, hogy kifejezze a matematikai formában a jövő reakció.
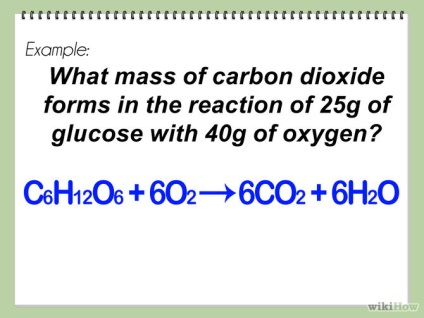
- Ha nem biztos, hogy pontosan vagy az egyensúly kémiai egyenlet, akkor olvassa el a cikket wikiHow: Hogyan írjunk egy kémiai egyenlet és az egyensúly is.
- 2 Adjuk meg a reagenseket. Vannak írva gyakran a bal oldalon a nyíl egy kémiai egyenlet. Ők is az úgynevezett „első anyag”. Lehet, hogy (mint a 2. rész) csak egy reagens.

- A számok mellett a szerek, ha van ilyen, az úgynevezett együtthatók. Azt mutatják a kapcsolat, amely felhasználja a reagenseket.
- Határ-reagens - a kiindulási anyag, amely véget ér az első. Válaszul, amelyben több kiindulási anyagok, ha nem használja az összes elsődleges anyag azonos moláris mennyiségben a arány 1: 1 egymással, az egyik reagenst az első dolog, hogy leállítja a reakció előrehaladását.
- 3. Számítsuk ki a mennyisége (mól) az egyes reagensekből. Ehhez osszuk el a súlya reagens annak azonos molekulatömegben.
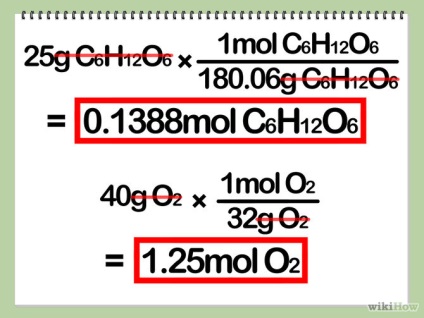
- Kiszámításához a móltömeg mol kiszámításához atomsúlya összes atom. Atomtömeg atom - egy decimális szám írta kémiai jele az egyes elemek a periódusos rendszerben. Megjegyezzük, hogy bármely számú indexált molekula azt jelenti, hogy ezek az atomok fordul elő egynél többször.
- 4. Ha két reagens, majd hasonlítsa össze az arány mol a reagensek aránya az együtthatók. Ennek megfelelően, ezek az arányok az úgynevezett „tényleges arány” és a „sztöchiometrikus arány”.

- Ha a tényleges aránya a sztöchiometrikus, ez azt jelenti, hogy a szer „feleslegben”, majd a másik a határ-reagens.
- Ha a tényleges arány kisebb, mint sztöchiometrikus, akkor ezt a reagenst korlátozza.
- 5 Ha több mint két reaktáns, akkor meg kell számolni a móljainak száma az egyes reagens termék után a teljes a reakció befejeződése. A reagens, amely a legkisebb mennyisége a termék a határ-reagens.

- Kiszámolni, hogy hány mol kap a reakció után, akkor szorozza meg az én szert az arány a termék sebességét és reagens arány.
- Ilyen számításokat reagens.
2. rész 3: számítása elméleti hozam
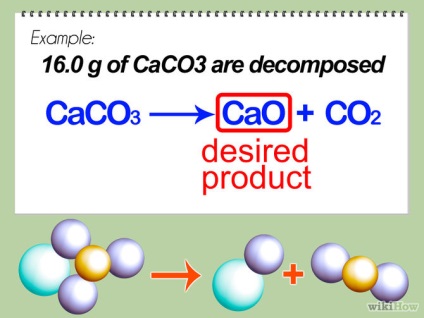
- 1 Határozza meg a kívánt terméket. Ő leggyakrabban felvett jobb, tekintettel a nyíl egy kémiai egyenlet. Ebben a példában, a CaO a mi kívánt terméket (CO2 - gáz és oldjuk meg a levegő). Kiszámoljuk az elméleti hozam - kiszámításához, hogy mennyi a termék, reméljük, hogy a leghatékonyabb választ.
- „Például a” Clare teremt 0.45gr ammónium-nitrát. Ez arra számít, hogy megkapja az elméleti hozam a termék tömeg a 0.50gr. Hány százaléka a megjelenése?
- 0,45 / 0,50 = 0,9. Szorozzuk meg az eredményt 100 arányának kiszámításához.
- A százalékos hozam 90%. Jegyezzük fel a súlyát minden a kiindulási anyag.
- 2 Állítsa be a tömeges korlátozó reaktánsok mólokban. Ezt megteheti, hogy elosztjuk a súlya reagens moláris tömege, mint az első része a 3. lépés.
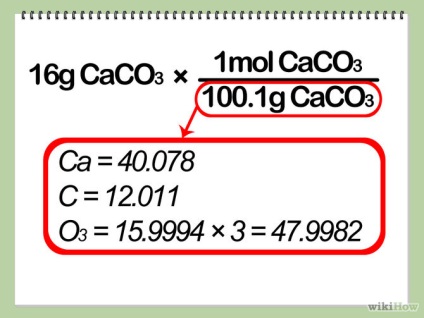
- 3. Adjuk meg a kísérleti arányt. Osszuk a kívánt móljainak száma termék per mól a határ-reagens. Ez a szám az úgynevezett kísérleti arányt.
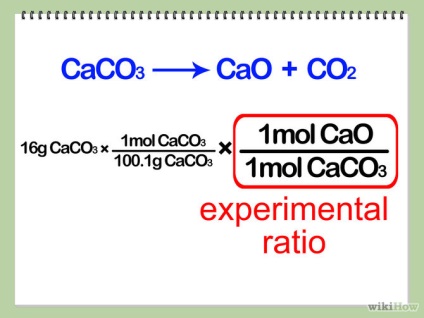
- 4. Számítsuk ki a moláris tömege egy mól a terméket. Írja ez az arány növekszik az egyenletben, az alábbiak szerint.
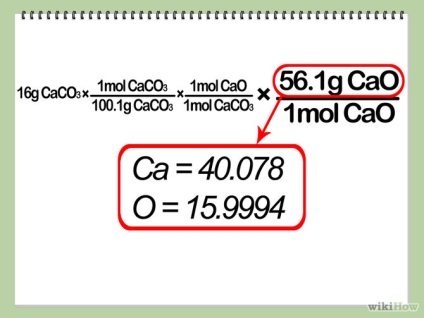
- 5 Tippeld elméleti kitermelés. Szorozzuk meg a móljainak száma a korlátozó A reaktáns a termék aránya együttható az együttható határ-reagens, majd szorozzuk az arány a moláris tömege a termék. Ez megadja a termék mennyiségét kapsz, ha a reakció a leghatékonyabb (más szóval, az „elméleti hozam” reakció).
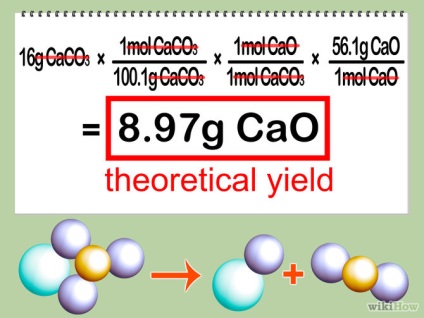
3. rész 3: Számítsuk ki a százalékos hozam
- 1 generálása reakciót. Vegyük a tiszta terméket a reakció, és kiszámítja a súlyát egyensúlyban. Számítsuk ki a tömeg.
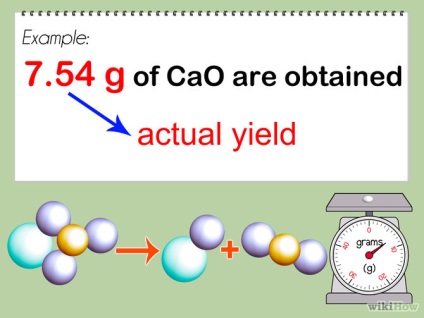
- 2 konvertálása a súlya a termék mól elosztjuk a súlya a molekulatömeg. Ez úgy történik, mint ahogy leírt két részből a fenti 2. lépésben. Rögzítse móljainak a száma kapott a kísérlet, mint egy aktuális kimenő.

- 3. Számítsuk ki a százalékos hozammal. Osszuk a tényleges kimenet az elméleti hozam, majd szorozzuk meg az eredményt százzal. Cserébe kapsz egy százalékát, ami azt mutatja, sok a termék, míg a termék tömege „ideális” választ.

figyelmeztetések
- Van rá esély, hogy kiszámítja a százalékos teljesítmény, ami több mint 100%, anélkül, hogy egy matematikai hiba. Ha a végtermék nem tiszta (szennyezett anyagok, amelyek nem szerepeltek az eredeti kémiai egyenlet), ezek a szennyező anyagok is kitölti, amely nagyobb, mint az elméleti hozam.
- Emiatt nagyon fontos, hogy alaposan tisztítsa meg a termékeket, a szűrés, szárítás, desztillálás és egyéb tisztítási eljárásokat, amelyek befolyásolhatják a fizikai tulajdonságok a termékeket.