Az elektrolitok általános jellemzői
Néhány elektrolit oldatban teljesen bomlik ionokká. Erősek.
Más elektrolitok csak részlegesen bomlanak ionokká, azaz molekuláik nagy része oldatban marad nem disszociált formában. Az ilyen elektrolitokat gyengenek nevezik.
Az anyag ezen tulajdonsága nem abszolút, és nemcsak a természetétől, hanem az oldószer természetétől is függ. Minél nagyobb az oldószer dielektromos állandója, annál erősebb az ionizáló gyengesége. Így a vizes oldatok (# 949; (H20) = 80). A LiCl és a NaCl hasonló erős elektrolitként viselkedik. De ha feloldunk ecetsavban (# 949; = 6) vagy acetonban (# 949; = 21), kezdenek tulajdonságait mutatják gyenge elektrolitok.
A vizes oldatok erős elektrolitok sók oldható bázisok (képződött, jellemzően alkáli- és alkáliföldfémek), valamilyen szervetlen vagy ásványi savak (sósav, HBr, HI, H2 SO4. HNO3 és mtsai.).
Ugyanakkor, sok szerves savak, néhány szervetlen sav (HNO2. HF, H2S, H2 SiO3. H3 PO4, stb), oldhatatlan H2O bázis viselkednek, mint a gyenge elektrolitok.
Azok az anyagok, amelyekben a részecskék különböző típusú kémiai kötésekkel kötődnek, első ionokra bomlanak ionokra
majd - a legpolárisabb kovalens kötések mentén
Az ilyen anyagok disszociációs folyamataiban, főszabály szerint, nem fordul elő kis poláros vagy nem poláros kovalens kötések heterolitikus szakadása.
Mennyiségi szempontból az elektrolitmolekulák ionba való bomlási folyamatát az elektrolitikus disszociáció mértékével # 945; .
A disszociáció mértéke az ionokba szétesett molekulák számához viszonyítva az oldatban lévő molekulák összes számához (bomló és nem széteső):
NO = ND + NH (az elektrolit oldatban nem disszociált molekulák száma)
Mivel egy anyag (N) részecskéinek és kémiai mennyiségének (n) az N = n relációhoz kapcsolódnak # 8729; NA. akkor a disszociáció mértéke más módon is kiszámítható:
Erős elektrolitokra # 945; közel áll az egységhez. Gyakorlatilag az összes oldott molekulája disszociált formában van, az asszociációs folyamat rendkívül elhanyagolható.
Ebben az összefüggésben az ilyen anyagok disszociációjának egyenletében a reverzibilitás jele helyett a "®" jelet (azaz a nyíl csak a bomlás irányában használja), például:
Gyenge elektrolit esetén a disszociáció mértéke nagyon kicsi (# 945;<<1). Так, для воды при 20 о С α ≈ 1 ∙ 10 –9. Это означает, что только одна молекула из миллиарда распадается на ионы. В растворах слабых электролитов, наряду с диссоциацией, непрерывно протекает и обратный процесс – ассоциация. С течением времени между ними устанавливается химическое равновесие, которое может быть смещено в ту или иную сторону.
Az elektrolit disszociációja következtében az oldatban lévő részecskék száma növekszik. Ez lehetővé teszi, hogy kísérletileg meghatározzuk a disszociáció mértékét az oldat azon tulajdonságainak méréséből, amelyek csak a benne lévő oldott anyag mennyiségétől függenek, de nem természetüknél, méretüknél vagy tömegüknél. Ezek a tulajdonságok magukban foglalják a forrás forráspontját és fagyáspontját, az ozmózisnyomást és mások.
Gyenge elektrolit oldatok esetén az értékek # 945, különböző módon definiálva, mint általában, egybeesik és mindig sokkal kisebb, mint az egység, ami jól illeszkedik az Arrhenius-elmélethez.
Amint azt kísérleti tanulmányok mutatják, a gyenge elektrolitok disszociációjának mértéke az oldat hőmérsékletétől és koncentrációjától függ.
8. táblázat Az ecetsav disszociációjának mértéke az oldatban lévő moláris koncentráció függvényében
Ssn3 szója, mol / dm3
Ahogy az oldat hőmérséklete emelkedik, a disszociáció fokozódik; míg a jobb polarizáció biztosított, és az elektrolitmolekulák kovalens poláris kötésének későbbi szakadása megkönnyíthető. Csökkenő hőmérséklet mellett # 945; csökken.
növekszik # 945; és az oldatok koncentrációjának csökkenésével, azaz ha hígítanak (8. táblázat), t. az ionokat elválasztó ionizáló réteg vastagsága nagyobb lesz, így ritkábban megfigyelhetjük az egymás közötti elektrosztatikus kölcsönhatást, ami az ionok molekulában való összekapcsolódásához vezet.
Határozottan nagy hígítással az elektrolit disszociációjának mértéke a maximális értékig tart, azaz az egységhez (30. ábra).
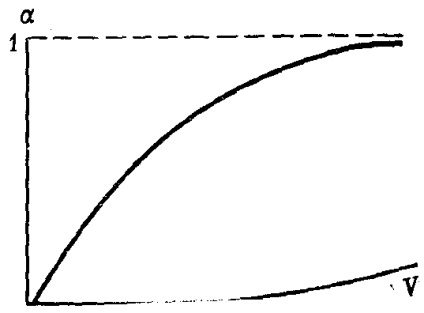
Ábra. 30. Az elektrolitikus disszociáció mértékének változása # 945; V hígítással (séma)
Így gyenge elektrolit esetén # 945; nem konstans. Ezért az ionokba való bomlási képességük sokkal kényelmesebb összehasonlítani a disszociációs állandóval, azaz az elektrolitmolekulák elektrolitikus bomlásának reverzibilis reakciójával.
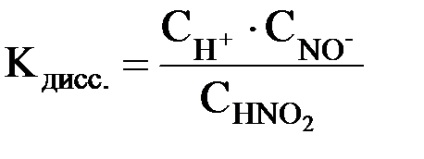
ahol CH +. СНO2 -. CHNO2 - a H + ionok egyensúlyi mólkoncentrációi. NO2 és nem disszociált HNO2 molekulák.
A gyenge elektrolitok disszociációs állandója nem függ az oldat koncentrációjától, még jelentős hígítás esetén is, és állandó marad egy adott hőmérsékleten (9. táblázat). A növekvő oldódási hőmérséklet mellett a gyenge elektrolitok disszociációs állandója sok esetben bonyolult módon változik (31.
9. táblázat: A Kdiss értékének függése. ecetsav koncentrációja T = 298 K-ban
Ssn3 szója, mol / dm3
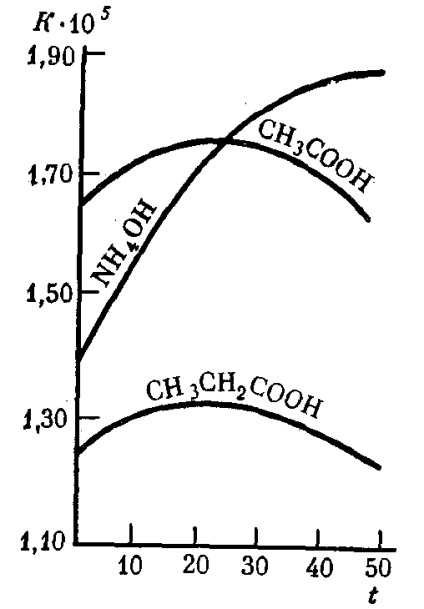
Ábra. 31. Az egyes gyenge elektrolitok disszociációs konstansának függése vizes oldatokban a t (° C) hőmérsékleten,
A kevésbé Kdiss .. a gyengébb az adott elektrolit. Például, ecetsavat (Kdiss. = 1,85 × 10 -5) közel 220.000-szor erősebb tsianovodorodnoy HCN (Kdiss. = 4,8 x 10 -10), és körülbelül 10-szer gyengébb, mint a hangyasav (Kdiss. = 1, 8 · 10-4).
Vannak gyenge elektrolitok (többbázisú savak, többszörös savas bázisok), amelyeknek a bomlása az ionokba lépésenként történik, pl. több szakaszban. Ebben az esetben az egyes szakaszokat disszociációs konstans jellemzi.
Például a hidrogén-szulfid disszociációja a 2 lépésben történik:
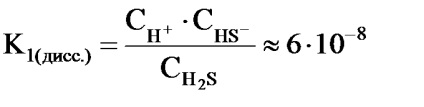
2) HS-H + + S2-
A H2S disszociációs reakció teljes egyenlete a következő:
H2S 2H + + S 2-
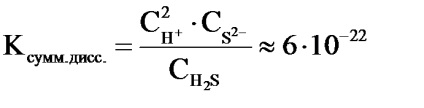
A disszociációs konstans nagysága a teljes egyenlethez és az egyes szakaszok disszociációs konstansjainak értékei egymáshoz kapcsolódnak egymással:
A lépésenkénti disszociációval a gyenge elektrolit minden egyes későbbi szakaszban történő bomlása kisebb mértékben fordul elő, mint az előző, azaz K1> K2> K3, és így tovább. Ezt azzal magyarázza, hogy az ionszétválasztás nem történik semleges molekulából (mint az első szakaszban), hanem egy egyre növekvő töltésű részecskebői, ezért nagy energiamennyiségre van szükség.
Gyakran a gyenge elektrolit erősségének értékelésére a disszociációs állandó helyett tizedes logaritmusa, az ellenkező jel (pK)
Ebben az esetben, annál nagyobb a pK értéke, annál gyengébb az elektrolit.