Alapjai ásványtan
2.2 A készítmény a földkéreg
Ez az első alkalom az összetétele a szilárd része a földkéreg tömegszázalékban becsült amerikai kutató F. Clark 1889-ben A legtöbb munkát a kapott számokat finomítását végezte VI Vernadszkij Fersman, I. és B. Noddak, G. Geveshi, Goldschmidt és Vinogradov. Utolsó számított átlagos kémiai összetétele a litoszféra csak (kivéve a hidroszféra és atmoszféra).
Több mint száz kémiai elemek szerepelnek a periódusos rendszer és a periódusos rendszer, csak néhány elterjedt a héja. Az ilyen elemek előnyösen úgy vannak elhelyezve a táblázatban a felső részén, vagyis a. E. Hasonló a elemek száma kis atomi számokat.
A leggyakoribb elemek a következők: O, Si, Al, Fe, Ca, Na, K, Mg, Ti, H és S. A részesedése az összes többi elem található a kéreg, már csak néhány tized százalék (tömeg). A legtöbb ilyen elemek a földkéreg van jelen szinte kizárólag formájában kémiai vegyületek. Elemei közül a talált natív formában, nagyon kevesen vannak. Ezek és mások az eredménye a kémiai reakciók, amelyek előfordulnak a földkéreg különböző geológiai folyamatok kialakulásához vezető különféle PA összesen tömb kőzetek és ásványi lerakódások.
Sok ilyen ritka elem a földkéregben alatt vliyaniemsovershayuschihsya jellegét geokémiai folyamatok gyakran obrazuyutisklyuchitelno gazdag klaszterek ásványi anyag nevét viselő az ércek. Ha nem lenne folyamatok kialakulásához vezet az ilyen betétek, amelyek volna smyslrazrabatyvat kivonat értékes fémeket az ipar, azt mondhatjuk teljes bizonyossággal, hogy nem lenne ilyen moschnogorazvitiya technológia és a kultúra, ami megfigyelhető jelenleg.
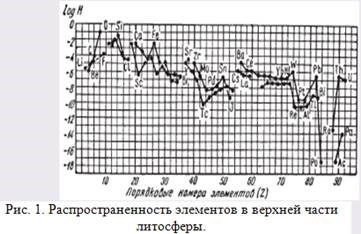
Ábra. 1. Előfordulás elemek a felső része a litoszféra.
Aztán sok a kivont fémek kőzetek a laboratóriumban voltak kizárólag drága. Jellemző, hogy klarkitakih fémek, például vanádium, cézium, gallium, stb Sokszor nagyobb Clarks higany, bizmut, ezüst, arany és mások. De annak ellenére, hogy nagyon tsennyesvoystva, nem gyakori az emberi élet, mint a betétek ipari koncentrációk a természetben rendkívül ritkák.
Természetes nehézfém vegyületek általában viszonylag egyszerű vegyület. Néhány ilyen elemek (Fe, Mn, Sn, Cr, W, Nb, Ta, Th, U) előnyösen formájában forgalmazzák, oxigén vegyületek, de sok más elem (Fe, Ni, Co, Zn, Cu, Pb, Hg, Mo , Bi, As, Sb, Ag, stb) találhatók elsősorban formájában klaszterek kén, arzén és antimon-vegyületek. Zhelezosovmeschaet tulajdonságait siderophilic, és lithophil chalcophilic elemek rendelkező értékelhető affinitást mind az oxigén és a kén.
A diagram (ábra. 1) danylogarifmy Clarkes atom (H) függvényében atomszámú (Z), ahol az oxigén telt egységenként.
A diagram a vízszintes tengelyen a sorszámai kémiai elemek, és a függőleges tengely - logaritmusainak azok atomnyhklarkov. Látható, hogy a növekvő atomi száma krivyeklarkov páros és páratlan elemek általában obnaruzhivayuttendentsiyu csökken. Ez azt jelenti, hogy a legtöbb himicheskihelementov bekövetkezik fordítottan arányos függését az átlagos tartalom a kéreg a sorozatszámot, bár vstrechayutsyai kivételek (például Li, Be, B és mtsai.).
3.1 Áttekintés
A figyelemre méltó jellemzője a sok természetes vegyületek színüket. Számos ásványi anyagokban, állandó és nagyon jellemző. Például, a cinóber (higany-szulfidot) mindig kármin A piros szín malachit jellemző élénk zöld színű, köbös kristályok pirit könnyen felismerhető fémesen arany színű, és így tovább. D. Ezen túlmenően, a nagy számú változó színekben ásványok. Az ilyen, például, kvarc fajták: színtelen (átlátszó) molochnoobelye, zheltovatooburye, majdnem fekete, lila, rózsaszín.
Lustre - is nagyon jellemző a sok ásványi anyag. Bizonyos esetekben ez nagyon hasonlít a csillogás fém (galenit, pirit, arzenopirit), másokban - az üveg ragyog (kvarc), gyöngy (muszkovit). Elég néhány ásványi anyagok, amelyek még a friss törés meg unalmas, így. E. Ne fényét.
Minden tulajdonságait ásványi anyagok (. Fizikai, stb) vannak oksági függés a jellemzői a kémiai összetétel és a kristályszerkezet az anyag - az alkotmány minee Ral, ami viszont, mérete miatt az atomok vagy ionok (részt a készítményben az ásványi) a szerkezet a elektronhéjak (különösen a külső) és a tulajdonságokat, amelyek helyzete határozza meg a kémiai elemek Mengyelejev rendszere. Ezért sok, amit korábban titokzatosnak látszott, most, a közelmúlt eredményeit egzakt tudományok, egyre több és több tiszta. Ezek az eredmények hozzájárulnak nemcsak a helyes megértése a természeti jelenségek, hanem segítenek a gyakorlati alkalmazás tulajdonságainak ásványi anyagok.
ásványi alkotmány képviseli egységét a kémiai összetétel és a kristályszerkezet. Az „alkotmány” kifejezés, mondhatnánk, a lényege az ásványi anyag; ez a saját, belső tulajdonságok, ellentétben más tulajdonságok és attribútumok, a válasz a külső hatásoknak, a megnyilvánult és kialakított interakció a környezettel. Ez egy ásványi alkotmány határozza meg fajok, a diagnosztikai tulajdonságok (attribútumok) az ásványi anyagok függvénye annak összetétele és szerkezete létrehozására használt fajok.
A legtöbb természetben előforduló ásvány által képviselt kémiai vegyületek. Az utóbbiak közé különböztetünk meg:
· A) vegyület állandó összetételű (daltonides) és
· B) vegyületek változó összetételű.
3.2.1 kapcsolatai állandó összetételű
Minden kémiai vegyületek állandó összetételű, mint ismeretes, az szigorúan a törvény több arányok (Dalton-törvény), és a törvény a nyújtás egységek, kötődési aránya a komponensek e vegyület a kapcsolatukat a más típusú kapcsolat. Ezek a törvények teljes mértékben megfelelnek a periódusos Mengyelejev, kristály kémia törvényei és a tanítás szimmetria kristályos médiában.
Jellemző, ezek a vegyületek számos speciális fizikai tulajdonságai, az egyértelműen kiálló fizikokémiai diagramok egyenletes eloszlása, oldhatóság, vezetőképesség, keménység, fajsúly, refraktív indexek, és így tovább.
Csak néhány egyed ásványok kialakított specifikus körülmények között a természetes desztilláció, közeledik a csomópont állandó összetételű. Mindazonáltal, mivel a eszményítésével sok hasznos ásványi anyagok hagyományosan tekinteni, mint egy vegyület, állandó összetételű.
Egy ilyen absztrakció az igazi készítmény lehetővé teszi a használatát a koncepció ásványfajt és jellemezze az egyének ásványi anyagok, bizonyos ásványi elme, egységes és viszonylag egyszerű kémiai képletek, tükrözve erőteljes funkciókat, általában nem állandó személyzet.
Közül bináris kémiai vegyületek közé tartoznak:
Tartalmazó vegyületek atomjainak három elem úgynevezett háromkomponensű; különböző sóit, mint az oxigén.
Vannak, persze, vegyületek bonyolultabb összetételű.
A kémiai összetétele a kémiai vegyület példája lehet két módon:
1) formájában tapasztalati képletek;
2) összetevőjeként vagy szerkezeti képletek.
Amellett, hogy a két- és háromkomponensű kémiai vegyületek a természetben gyakori és több komplex vegyületek, mint például a kettős sói. Dupla sók azok a vegyületek, állandó összetételű, amely áll legalább két egyszerű sók jelen többféle módon. A legtöbb esetben, ezek a sók kettős kation, legalábbis - a anionok vagy mindkét kationok és anionok. A következőket említhetjük példaként:
Amellett, hogy a kémiai vegyületek állandó összetételű kapott általában a laboratóriumban tiszta kiindulási komponenseket, van számtalan ilyen vegyületek, amelyek összetétele nem állandó, hanem változik a keskeny, akkor szélesebb körben, és ezek az ingadozások a készítményben nem magyarázható a jelenléte bármely mechanikus vagy idegen anyag szennyeződések. Fordítva, oszcilláló kristályszerkezetének vegyületek szempontjából az magyarázza, oldhatósága az alkotó komponensek a vegyületet.
Az ilyen kémiai entitások nevezzük változó összetételű vegyületek.
Vegyületek közül ásványok különböző összetételű többségben. A létezése anyagok (fázisok) változó összetételű úgy tűnik, hogy a természetes, ha ez egy folyékony oldatot, amelynek összetételét úgy határozzuk meg, az arány az oldott anyag és az oldószer. Tehát a készítmény az oldat tól tiszta oldószer egy telített oldat; ez lehet bármilyen folyamatos sor lehetséges készítmények a tartományban, attól függően, hogy a hőmérséklet és a nyomás. Az a képesség, a kristályos anyagok különböző összetételű alkotnak folyamatosan változó összetételének vegyület azonos kristályszerkezet alapján izomorfizmus, t. E. Tulajdonság az atomok különböző elemeinek egymással felcserélhető szilárd kémiai vegyületek.
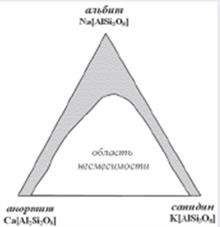
Rendszerek izomorf helyettesítést lehet több, mint kétkomponensű. Abban az esetben, az ilyen rendszerek, beszélünk nem a sorozat, de a mezők és egész területeket izomorf keverhetőség, mint jellemző, például földpátok (ábra. 2) magas hőmérsékleten, amikor kitéve keverési és plagioklász földpát.
Ionátmérője függőleges csoportok, a periódusos rendszer elemeinek növelésével nő rendszámú és csökkentette a vízszintes irányban a növekedés a csoport szám (m. E. A növekvő vegyérték). Ezen az alapon Fersman származtatott jog átlós sorokat izomorf ion a periódusos rendszer elemei, tisztességes a bal oldali részén. A következőkben felvázoljuk heterovalent rangsorolja ionok izomorfizmus (zárójelben mutatja a ionátmérője angströmben):
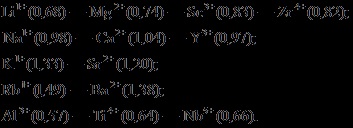
Valóban, a természetes vegyületeket gyakran megfigyelhető, hogy a lítium ásványok, például, tartalmazhat izomorf szennyező magnézium, magnézium ásványi anyagok - szennyező szkandium, nátrium - kálcium szennyezők, a kalcium - ittrium szennyeződések, stb ...
A vegyületek között lehet csak vízzel tulajdonítani, hogy az összetételében tartalmazhat elektromosan semleges vízmolekula.
Attól függően, hogy milyen módon víz megmarad ásványok különböztetünk meg:
1) kristályosítással vagy kötött vizet, ásványi anyagokat tartalmazza a kristályos szerkezet;
2) a szabad víz nem vesz részt a szerkezet a kristály.
Bound víz a kristályszerkezet részt vesz formájában H2 O molekulák elfoglaló szigorúan bizonyos helyeken. A vízmolekulák száma van egy egyszerű kapcsolat a többi komponensek a vegyület. A példákban a következő: Na2CO3. 10H2O (szóda), Ca [SO4]. 2H2O (gipsz), Ni3 [AsO4] 2. 8H2O (annabergit) Al2 [PO4] (OH) 3. 5H2O (wavellite)
Ez az úgynevezett kristályos hidrátok, amely szerint a Werner, figyelembe kell venni, mint „komplexek”, t. E. Azok, amelyekben a vízmolekulák a szerkezeti egységek vannak elrendezve egy bizonyos koordinációs körül minden ionok, ami ilyen módon egyfajta komplex ionok.
Szabad víz jelen a csonttömeget, azzal jellemezve, hogy nem vesz részt közvetlenül a szerkezet a kristályos szilárd anyag ásványi anyagok. Hevítve, akkor fokozatosan szabadul fel.
Háromféle szabad víz:
2. MP Shaskol'skaya "Kristálytan" - Moszkva, "High School" 1984.
4. Bulakh AG „Ásványtani alapjait krisztaiiográfíai” - Moszkva, Nedra, 1989.