oxigén alcsoport távoli tanulságok
Elemei a 6. csoport a fő csoport. Nagyon gyakran használt neve - kalkogén - „érc született”. Azt hiszem, ezt a nevet ők inkább kénytelenek kén, mint az oxigén 🙂
Ebben a formában a készítmény a vizsgára, figyelembe vesszük a fizikai és kémiai tulajdonságai, a két elem - az O oxigén és kén S.
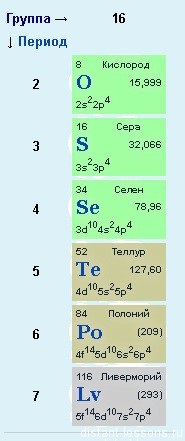
De ez nem olyan egyszerű.
Oxigén nincs panasz - azt az elektronikus szerkezet az általános képlet, és itt a kén és egyéb elemek, vannak más lehetőségek ... Ha vizsgálja részletesen a szerkezet a p-elemek időszakokban. meg kell megjegyezni, hogy a harmadik időszakban, p- elemek van egy szabad D-orbitális, amely át tud hatolni az elektronok.
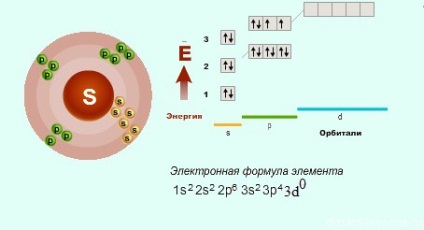
Ezért a mértéke kén oxidációs nem csak -2.
- Vegyértéke az elemek:
- oxigén vegyérték 2,
- vegyértéke kén - 2,4,6
- Az oxidáció mértéke:
- oxigén oxidációs állapot = -2 - tipikus nemfémes erős oxidálószer;
- a mértéke kén oxidációs = -2 (minimális mértékű oxidáció), 2 (ritka), +4, +6 (maximális oxidációs szám) minimális sd S mutatnak redukáló tulajdonsága. maximális - oxidáció.
- Felülről lefelé az alcsoportjában atomrádiusz növekszik, ezért gyengébb elektronokat vonz a atommag, ezért a fém tulajdonságait lefelé növekszik.
- Ennek következtében fentről lefelé egy részhalmaza fokozott helyreállító tulajdonságait.

Kén - S - szilárd, bár írunk képletű ennek az anyagnak, mint az S. kristályok képződnek, de jellemzően a kompozíció S4 és S8. Jellemzően, a kén - műanyag anyag barna vagy sárga.
Égő kén levegőben: S + O 2 = SO 2 (színtelen gáz, szúrós szagú)
- Hidrogén + oxigén:
- 2H2 + O2 = 2H2O kvalitatív reakció oxigén - a folyamat egy tipikus pamut.
- H2 + O2 = H2O2 - hidrogén-peroxid
- Fémek + oxigén:
- 4Li + O2 = 2Li2O - alap-oxid
- Nemfémes + O2:
- S + O2 = SO2 - savas-oxid
- Oxidok + oxigén:
- 4FeO + O2 = 2Fe2O3 - a reakció bázikus oxidok nem-tercier oxidációs
- 2SO2 + O2 = 2SO3 - a reakciót savval oxidok nem-tercier oxidációs
Oxigén lehet redukáló tulajdonsága csak egy elem, amely nagyobb eiektronegativitás azaz kellene lennie a periódusos jobbra az oxigén. Ez KING NON - F:
- F2 + O2 = OF2 (itt az oxigénnek egy oxidációs állapota +2)