analitikai mérés
meghatározás
pH meghatározása a negatív logaritmusa hidrogénion aktivitása, aH +, in rastvore.Takim módon: pH = - log (Ah +)
pH mérés Technology
pH mérjük a berendezés két elektróda: mérőelektród és referencia elektród. Ez a két elektróda gyakran kombinálják egyetlen, amely az úgynevezett „elektród kombinációja.” Minden pH-elektródok szállított FLS, vannak „kombinált”.
Amikor két elektróda van az oldatban bemerítve, az elektrokémiai cella van kialakítva kicsi. A kifejlesztett potenciál függ mindkét elektróda.
A mért feszültség fejezhetjük ki a Nernst-egyenlet a következőképpen:
E = Emeas - EREF = E0 - (2,303RT / F) pH, ahol
E = a mért feszültség
Emeas = feszültség mérőelektród
Feszültség EREF = referencia elektród
E0 = a standardpotenciál
R = gázállandó
T = abszolút hőmérséklet
F = a Faraday-állandó
Továbbá, ez azt jelenti, hogy a kapcsolat a pH és E lineárisan korrelált hőmérsékleten.
Slope érték + 25 ° C-on 59,18 mV / pH. Ez körülbelül 54 mV / pH-érték a + 5 ° C és körülbelül 62 mV / pH-érték a + 40 ° C-on A + 100 ° C-meredeksége növekszik körülbelül 74 mV / pH.
Technikai szempontból pH
Meghatározása az eltérés, és a görbe meredeksége a rendszer pH-ját.
Ahhoz, hogy értékeljük a jellemzői mindkét elektród kalibrációs kell végezni mindkét pontok pH.
Kalibrációs mintaoldat végezhetjük a tanulmány a vegyi anyagok, amelyek befolyásolhatják a pH-mérés.
kalibrációs oldat (puffer folyadék)
A megoldás egy ismert értékű pH, használt pH kalibrációs rendszerrel.
A kalibrációs oldatok befolyásolja a hőmérséklet.
A függőség a puffer folyadék hőmérséklete jól ismert.
Ezután fel kell tüntetni a függőség puffer szállított folyadék FLS:
Összehasonlításképpen, a pH indikátorok gyakran korrelál egy adott hőmérsékleten, általában + 25 ° C-on
automatikus hőmérséklet kompenzáció
Algoritmusok automatikus átalakítása a minta pH a hőmérséklet szabályozására.
Ez a funkció figyelembe veszi változások a pH görbe a hőmérséklet függvényében.
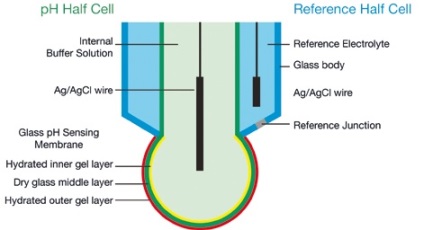
A működési elve pH-elektród
pH-elektród egy nagyon nagy impedanciájú elektrokémiai cella, amelyben a potenciális között képződött pH fél-cella és a referenciaelektród az összege a különböző potenciálok. Ábra A része mutatja egy tipikus kombinált üveg pH-elektródát, ahol a pH-félcella és a referenciaelektród kombinálva van egy szerkezet.
Ideális esetben az összes a potenciálok állandó, kivéve egy, generált a külső réteg a hidratált gél, amely függ a pH-szonda, összhangban a Nernst-egyenlet.
Valódi elektródák eltérnek az ideális elektróda miatt számos tényező, többek között:
1) A gyártási tűrések;
2) öregedési az elektród;
3) a hasznosítás és tisztítását az elektróda.
Minden pH-méter lehetővé kalibrálás vagy szabványosítását elektród, hogy kompenzálja a fent említett hatásokat. Standard kalibrációs során megmérjük egy az elektród reakcióját két pH-pufferek ismert értéke pH, és megteremti elektródválaszt térképeit a két pontot. Ezek az eredmények, mint az eltérés korrekciós együtthatókat és a meredeksége a görbe, ahol az eltérés a feltérképezése mV pH = 7, és a meredeksége a görbe a válasz változása egységnyi mV pH, általában kifejezett mV / pH, képviseli a százalékos aránya az ideális elektród meredeksége görbe (59.16 mV / pH 25 ° C-on).
ORP
meghatározás
A redox potenciál (ORP) olyan intézkedés tendencia a megoldást oxidációs vagy dezoxidációs, hogy lehet vele kapcsolatba.
Ezután az oxidálószer egy folyékony, hajlamos fogadják be az elektródákat, oxidáló, hogy a velük való érintkezésből, dezoxidélás magát.
Dezoxidáló oldat egy folyékony, hajlamos elveszíteni elektródák dezoxidáló, hogy velük a kapcsolatot, oxidáló magát.
ORP méréstechnika
ORP elektróda feszültséget állít elő, valamint a pH-elektród. Ebben az esetben, a mérés befolyásolja nemcsak hidrogén-ionok, hanem az összes olyan vegyi anyagokkal nyújtani vagy kapni elektronokat.
Bár ORP befolyásolja a hőmérséklet, és elvileg, ez legyen a Nernst-egyenlet, nehéz kompenzálni a mérés, mert általában nem ismert, hogy hány elektron vesz részt a redox reakciók (amikor ORP mérés csak arra használjuk, és a reakciót meghatározhatja a gyökér érintett fél reakció, ezért lehet do).
A ORP mérés is telepítéséhez használt két elektróda: mérőelektród és referencia elektród. Ez a két elektróda gyakran kombinálják egyetlen, amely az úgynevezett „elektród kombinációja.” Minden ORP elektródok által szolgáltatott FLS, vannak „kombinált”. Amikor két elektróda van az oldatban bemerítve, az elektrokémiai cella van kialakítva kicsi.
A kifejlesztett potenciál függ mind elektródák és jellemzően tól -1000 mV +1000 mV.
Bár ezt a mérést nem kapcsolódik egy adott folyadékban nagyon hasznosak lehetnek a nyomon követése és ellenőrzése az aktivitását bizonyos vegyületek. A gyakorlatban, a használata ORP ellenőrzésére és szabályozására oxidációs-dezoxidáló reakciók használni, hogy elpusztítsa cianid, deklórozás, nitrit és szulfit oxidációs, deoxidaláshoz kromát, hipoklorit fehérítő, és monitorozásához is kefék klórdioxid és klór-hidrogén-szulfit. koncentráció mérés AFP problémás, de ORP lehet használni bizonyos esetekben, hogy észlelje a szivárgásokat, hogy meghatározzuk a oxidálószer jelenlétében, vagy egy dezoxidáló szer.
Végül, bizonyos esetekben, az ORP mérjük szabályozására biológiai mikroorganizmusok növekedését. Az elv a kérelmet, hogy a minimális érték ORP mikroorganizmusok sikeresen elpusztította. Ezt a módszert a klórozás a medencék és hűtőtornyok. Meg kell jegyezni, hogy a két alkalmazás is végzett a pH beállításához.
Technikai szempontból AFP
Meghatározása redox rendszer rendellenességek.
A legtöbb alkalmazás esetén az ORP abszolút pontossága kevésbé fontos, mint a sebesség és a relatív változások a rendszerben. Sok kívánt értékeit ORP szükséges eljárások és előírások tűréssel ± 25 mV és ± 50 mV, vagy azonosító változások a ORP, például, egy csepp 400 mV, a végső értéket. Mivel a mutatót használjuk a különböző AFP esetben saját speciális módszerek az olvasás a szükséges teljesítményt vagy a változásokat mutató, mert a tapasztalatok alapján nem tudjuk fejleszteni a technikát részletesen. Elég annyit mondani, hogy a pontosság szükséges a pH-mérést és egyéb elektrokémiai méréseket rendszerint nem használják ORP, így a kalibráció ORP elektródok és műszerek nem olyan gyakori.
A megoldás egy ismert ORP értéke hitelesítéshez használt BDN rendszer.
Mint fentebb kifejtettük, az abszolút érték ORP nem olyan fontos, ezért ORP kalibráló oldatot csak akkor használható, ellenőrzés céljából.
Alapvetően kalibráló oldatot vagy kontroll oldatot ORP célja kizárólag összehasonlítás megkönnyítése érdekében.
Más szóval, egy becslés eltérése lehet kötelező csere esetén az elektróda, amikor egy új érzékelő méri különböző értéket a korábbi elektróda azonban kalibrálás lehet szükség, hogy ellenőrizze az új érték az előzővel. Például, ha az eljárás megköveteli a kívánt értéket a 410 mV-os felhasználásával határoztuk meg az előző elektróda és a készülék egy jelzést egy új elektród ugyanazzal a szerszámmal lehet létrehozni 425 mV azonos folyadék. A kalibrálás vagy, pontosabban, a kiigazítás eltérést megszünteti a különbség a 15 mV-os, a félreértések elkerülése végett. Aztán, amikor elolvassa a következő indikációk azok könnyen, mint az előző elektróda olvasmányok.
A működési elve az ORP elektróda
A mérési elv az, hogy az ORP elektróda inert fém (platina, arany néha, ritkán ezüst), amely miatt az alacsony ellenállású adományoz elektronokat az oxidálószer vagy felvesznek elektronokat egy dezoxidáló szer. ORP elektród továbbra is elfogadja, vagy adományozni elektronokat, amint a fejlesztés miatt a töltés felhalmozódásának egyenlő AFP oldatot. Jellemzően az ORP mérési pontosság ± 5mV. Szintén ORP elektród igényel referencia elektród, amely általában azonos elektróda ezüst-ezüst-klorid, mellyel a pH mérés.
vezetőképesség
meghatározás
A vezetőképesség az a képesség, a megoldást, hogy vezeti az elektromos áramot. A jelenlegi megoldások tolerálható kationokat és anionokat.
Az, hogy az oldat áramvezetôvé több tényezőtől függ:
- koncentráció
- ion mobilitás
- vegyértéke ionok
- hőmérséklet
Minden anyagot különböző mértékű vezetőképesség. Vizes oldatban az ionerősség szintje változik a kis vezetőképességű ultratiszta vizet a nagy vezetőképességű koncentrált kémiai minták.
vezetőképesség méréstechnika
Vezetőképesség mérhető alkalmazásával elektromos áram (I), hogy a két elektróda az oldatban bemerítve, és mérjük a keletkező feszültség (V). A folyamat során, kationok vándorolnak a negatív elektród és anionok - a pozitív elektród, és az oldatot viselkedik, mint egy elektromos vezető.
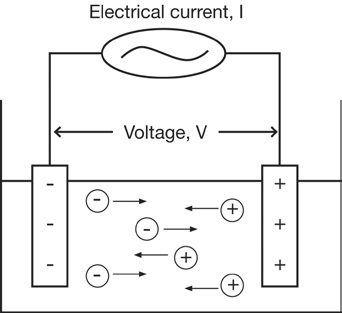
Az ellenállás az oldat lehet számítani (R), Az Ohm törvényét
(V = R x I).
R = V / I
ahol:
V = feszültség (V)
I = áram (AMPS)
Megoldás R = ellenállás (ohm)
A vezetőképesség (G) úgy definiáljuk, mint a kölcsönös a villamos ellenállás (R) az oldat két elektróda közötti.
Tény, hogy a vezetőképesség-mérő méri az elektromos vezetőképesség és megjeleníti az olvasási alakítjuk vezetőképesség.
Ez kapcsolatban közötti távolság (d) az elektródok között és a terület (a) az elektródák.
K = d / a
K = állandó elem (cm-1)
a = az elektród effektív területe (cm2)
d = az elektródák közötti távolság (cm)
A villamos energia egy elektronok áramlását. Ez azt jelenti, hogy a megoldás az ionok vezetik az elektromosságot. Vezetőképessége a megoldás a képességét áram. Indikációk minta vezetőképessége változik a hőmérséklettől függően.
C = G x K
C = vezetőképesség (S / cm)
G = konduktancia (S), ahol G = 1 / R
K = állandó elem (cm-1)
Ez a kölcsönös a értéke a vezetést, ami mérik ohm • cm. Jellemzően, arra korlátozódik, hogy a mérés a tiszta víz, amelynek vezetőképessége igen alacsony.
Annak megállapításához, az elem állandó kell, hogy átalakítani leolvasás a vezetési az elektromos vezetőképesség eredményeket.
A megoldás egy ismert vezetőképességű érték kalibrálására a vezetőképesség a rendszer.
Összehasonlításképpen, a vezetési arányok gyakran korrelál egy adott hőmérsékleten, általában + 18 ° C-on, + 20 ° C-on vagy 25 ° C-on
automatikus hőmérséklet kompenzáció
Algoritmusok automatikus átalakítása a minta vezetőképességet szabályozó hőmérséklet.
hőmérséklet kompenzációs együtthatót
Factor használt automatikus kompenzáció. Általában% -ban kifejezve / ° C-on
Használható tisztaságú vizet (UPW) mérőeszközökkel FLS különleges összefüggés alapján ASTM D1125-19.
összes oldott szilárd anyag (TDS)
Ez a mérés a teljes koncentrációja ionos anyagok a mintában.
A műszer szerint kalibrált standard oldatot vagy sóoldatot, amely a felhasználó úgy döntött, hogy használni, mint egy kontroll minta.
Vezetőképesség leolvasást alakítjuk TDS leolvasott ismert matematikai szorzás együttható. A koefficiens függ a kontroll készítmény (általában sóoldat) előállítására alkalmazott standard vagy kontroll anyag. Például: tengervíz tartalmaz sok különböző sók, de főleg NaCl, így a felhasználó összefüggésben lehet csak vele. Íme néhány példa a tényezők:
transzformációs együttható tartomány
Technikai szempontból vezetőképesség
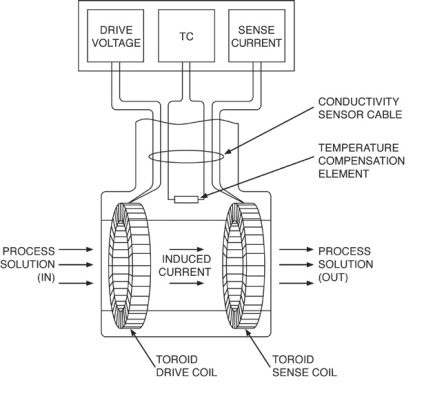
toroid induktív mérő szerkezettel vezetőképesség
Induktív toroid vezetőképesség szenzor két nagy toroid (tekercsek) koncentrikusan, és egymás mellett ágyazott nemvezető házban. primer tekercs gerjesztve lett egy szinuszos váltakozó feszültség, ami egy váltakozó mágneses tér. Ez a váltakozó mágneses mező hatására az ionok az oldatban utazni közepén keresztül a toroid. A mozgása ionok ekvivalens egy váltakozó áram halad át a központ a toroid. A váltakozó áram termel egy váltakozó áram a mérőtekercs, amely arányos a vezetőképesség az oldat. Ideális esetben a jel a mérési tekercset kell kondicionálni csak mozgó ionokat és nem a váltakozó mágneses tér által keltett primer tekercs. Emiatt a tekercsek között szüksége van jó mágneses ekranirvanie.
letöltés PDF
Létrehozása site „Defi”