A szerkezet a komplex vegyületek
Abban a pillanatban kialakulását és tulajdonságait komplexek a vegyületek megmagyarázható az elmélet a módszer a vegyérték kötések (BC), a kristálytér (FBH) és az elmélet a molekulapálya (MO).
Az alábbiakban röviden néhány példát az egyes elméletek.
Az elmélet az eljárás vegyértékkötéseket
Kétéltű elmélet az képződését komplex ionok, mint a donor-akceptor kölcsönhatás a nem megosztott elektron párokat és a szabad ligandumokat pályák komplexképző szer.
Tekintsük a komplex ion [Co (NH3) 6] 3+
2 1s 2s 2p 2 6 2 3s 4s 3p 6 0 6 4P 3d 4d 0 0
A szabálynak megfelelően Hund elektronok a külső energia szinten elrendezve a következőképpen:
Komplexképző szer koordinációs száma cn = 6, 6 ezért csatolja ligandumok, amelyek mindegyike rendelkezik egy osztatlan elektronpárt, és ezért, egy elektrondonort. Acceptor (komplexképző) elhelyezésére hat elektronpár kell biztosítani hat betöltetlen pályák. A komplex képződését ion [Co (NH3) 6] 3+ négy páratlan elektron a d - Co 3+ első állapot formában elektron párokat, miáltal két 3d-pályák mentesített:
Aztán kialakult komplex iont [Co (NH3) 6] 3+. amelynek szerkezete a következő:
A komplex képződését ion részt belső 3d-orbitális és a külső 4S- és 4P-pályák. hibridizáció típusú - d2sp3.
Miután csak párosított elektronok mondja diamágnesesek ion.
Kristálytér
Kristálytér azon a feltételezésen alapul, hogy a kapcsolat a komplexképző ligandum és részben ionos. Azonban figyelembe véve a hatása az elektrosztatikus mező ligandumok az energetikai állapotának az elektronok a központi ion.
K2 [Zn (CN) 4] - van egy tetraéderes térszerkezet (SP3 - hibridizáció)
K3 [Fe (CN) 6] - rendelkezik oktaéderes térszerkezet (sp3d2 hibridizáció)
Komplexképző szerek a következő elektron konfiguráció:
d - elektronok az azonos energia szintje azonos az esetben, ha a szabad atom vagy ion. De az akció az elektrosztatikus mező ligandumok elősegíti a felosztása energiaszintjét d - pályák a központi ion. És ketté az több (egy és ugyanaz a komplexképző), annál erősebb a mező által termelt ligandumok. Az, hogy képesek okozni egy hasító az energia szintjét ligandumok elrendezve egy sorban:
CN -> NO2 -> NH3> SCN -> H2 O> OH -> F -> Cl -> Br -> I -
A komplex szerkezetét ion befolyásolja a karakter a felosztása az energiaszintet, komplexképző szer.
A oktaéderes komplex szerkezetét ion, dγ pályák (DZ 2 -, dx 2 -y 2 pályák) vannak kitéve erős ligandum mező kölcsönhatások. és elektronok ezen pályák lehet egy nagyobb energia, mint az elektronok dε orbitális (DXY dxz, dyz -. pályák).
A felosztása a energia szintet elektronok a d-state oktaéderes ligandum mező lehet képviseli a rendszer:
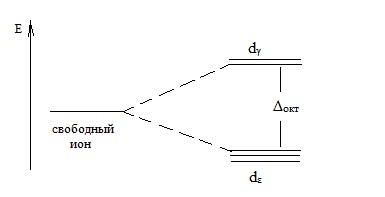
Itt Δokt - hasító energia oktaéderes ligand területen.
Tetraéderes koordinációs komplex ion dγ pályáknak kisebb energiát igényel, mint az orbitális dε:
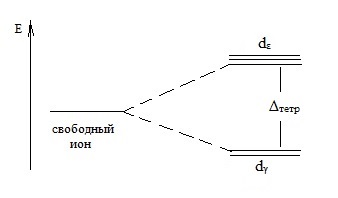
Itt Δtetr - hasító energia tetraéderes ligand területen.
Energia hasító delta kísérletileg meghatároztuk az abszorpciós spektrumát fénykvantum anyag, amelynek az energia egyenlő az energia megfelelő elektronikus átmenetek. Abszorpciós spektrum, valamint a színező és komplex vegyületek d-elemek miatt elektron átmenetet d-orbitális a legalacsonyabb energiájú d-orbitális egy magasabb energia.
Így, abban az esetben, sói K3 [Fe (CN) 6], a felszívódását fénykvantumok, valószínű átmeneti elektron orbitális dε dγ orbitális. Ez magyarázza, hogy a só narancsvörös színű. Só, K2 [Zn (CN) 4] nem elnyelni a fényt, és ezért ez színtelen. Ez annak a ténynek köszönhető, hogy az átutalás elektronok orbitális dγ a dε orbitális kivitelezhetetlen.
Molekulapálya elmélet
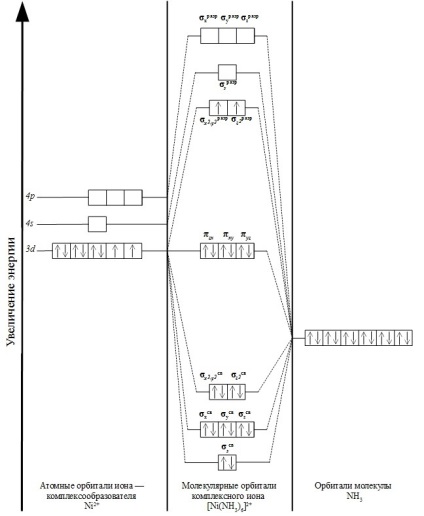
Ezzel a módszerrel, a magas-spin elektronikus konfiguráció ábrázolják komplex iont [Ni (NH3) 6] 2+.
Az elektronikus konfigurációja Ni2 + -ion:
1s 2 2s 2 2p 6 3s 3p 6 4S 2 0 3d 8 4p 0 4d 0 vagy 0 ... 4s 3d 8 4p 0 4d 0
A komplex ion [Ni (NH3) 6] 2+ a kialakított kémiai kötésen vesz részt a központi 8 Ni2 + -ion és elektronok 12 elektronok hat NH3 ligandumok.
Komplex ionnal is van egy oktaéderes szerkezet. MO oktatás csak akkor lehetséges, abban az esetben, ha a kezdeti energia a kölcsönható részecskék közel a saját értékeit, valamint orientált térben kell.
Ebben az esetben, az orbitális 4s Ni2 + -ion egyenértékű pályák átfedi mind a hat ligandumok. Ennek eredményeként a molekulapályák képződött: σs összekötő kommunikációs és antibonding σs kisülés.
Átfedő három 4P-pályák pályák kompiexáióligandumoknak képződéséhez vezet hat cr p-pályák: kötési σh kommunikáció. σy kommunikáció. σz kötési és szétesést σh kisülés. σy mentesítést. σz mentesítést.
Átfedő dz 2 és DX 2 -Y 2 komplexáló ligandumok pályák elősegíti a kialakulását négy molekulapályák: két kötési σ x 2 -y kommunikációs 2. σ Z 2 kötő és σ antibonding két bit x 2 - y 2. σ 2 z bites.
Pályák DXY. dxz, dyz Ni2 + -ion nem kötődik a ligandumhoz pályák, mint nem irányul rájuk. Emiatt nem vesznek részt a kialakulása σ-kötés és a nem kötő pályák: πxz. πxy. πyz.
Összesen komplex ion [Ni (NH3) 6] 2+ tartalmaz 15 molekulapályák. Hely elektronok képviseletében a következő:
Vázlatosan, a kialakulását molekulapályák ábrán látható módon az alábbi: