A koncepció a hőkapacitása anyagok
Teploemkostsistemy (vagy szerv) - az aránya a üzenetek száma a megfigyelt hőt a rendszert, míg a hőmérséklet növelésével (hiányában kémiai reakció, az anyag átmenet egyik állapotból a másikba).
A hőkapacitás arányos az anyag mennyiségét. Megkülönböztetése specifikus és moláris hőkapacitás.
Fajlagos hő Court - a hőmennyiség szükséges az anyag melegítése tömegegység per 1 mértékegység K. fajhő - J / (K x g).
A moláris fajlagos hő - ez az a hőmennyiség melegítéséhez szükséges 1 mól 1 K. egység moláris hőkapacitás - J / (mol × K).
A moláris fajlagos hőkapacitása és kapcsolódnak a:
,
ahol M - moláris tömege.
Megkülönböztetni az átlagos és az igaz hőkapacitása.
Az átlagos hőkapacitása határozza meg az arány a jelentett hő-rendszer a megfigyelt növekedése a hőmérséklet egyidejűleg:
Az igazi hőkapacitása C megfelel infinitezimális a hőmérséklet-változás:
Ez könnyű közötti kapcsolat létrehozásához az átlagos és a valódi konkrét melegíti, integráló (1,8) közötti hőmérséklet-tartományban a T1-T2, és helyettesítjük a kapott kifejezés Q (1.7):
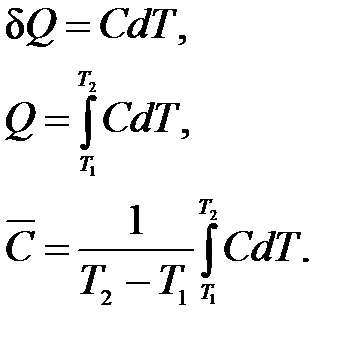
Attól függően, hogy a feltételeket, amelyek mellett a melegítést végezzük, megkülönböztetni a fajhő állandó térfogaton Cv (izochor hőkapacitása) és hő állandó nyomáson Cp (izobár fajhő):
Amennyiben melegítést végezzük V = const. minden hő megy, hogy növelje a belső energia; ha p = const növelése mellett a belső energia a munka expanzió végezzük.
Ha a állandóságának volumen vagy nyomás előírt parciális deriváltja a (1,9) helyettesítjük komplett:
Integrálása egyenlet (1.10) a hőmérséklet-tartományban a T1-T2. és feltételezve, hogy a CP és Cv ebben a hőmérséklet-tartományban állandó, kapjuk:
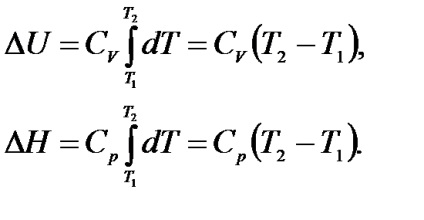
Közötti kapcsolat megállapítása Cp és Cv 1 mol ideális gáz. Összhangban Mengyelejev-Clapeyron egyenlet (1.1)
.
Izobár és izochor hőkapacitása ideális gáz különböznek az egyetemes gázállandó R.
Egy egyatomos ideális gáz
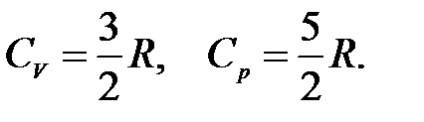
Egy kétatomos ideális gáz mérsékelt hőmérsékleten
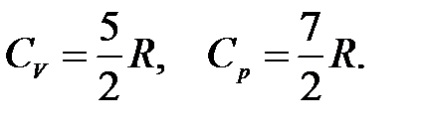
Izobár és izochor hő kapacitások szilárdanyag-tartalma gyakorlatilag egyenlő.
A fajhője szilárd, folyékony és gáz halmazállapotú szervek a hőmérséklettől függ. Leggyakrabban a függőség a hőkapacitása egyes anyagok hőmérséklet fejezi ki az empirikus egyenlet a következő formában:
ahol a. b. c. c „- empirikus együtthatók alapján számított a kísérleti adatok.
Szerves anyagok együttható c „= 0, szervetlen - c = 0.
Ez az empirikus egyenlet csak akkor alkalmazható, egy bizonyos hőmérséklet tartományban. Ezért, az együtthatók a, b, c és c „nincs fizikai értelme. Több olyan anyag felsorolt folyóiratok (jelezve a hőmérséklet, ahol fel lehet használni).
1.3.3 hatása a hőmérséklet a termikus hatása
kémiai reakció. Kirchhoff egyenlet
A hőmérséklet jelentősen befolyásolja a hőhatás a kémiai reakciókat. Mi jelent a probléma számszerűsíteni ezt a hatást.
A kémiai reakció előforduló p = const:
.
Tegyük fel, hogy a entalpiája kiindulási anyagok a reakcióban résztvevő egyenlő H1. és a entalpiája a reakciótermékek - H2. majd
ahol - a hőkapacitása a rendszer kezdeti állapotban:
.
Hasonlóképpen, a reakció termékek:
.
Kivonása távon távú egyenletből (1,13) egyenlet (1,12), kapjuk:
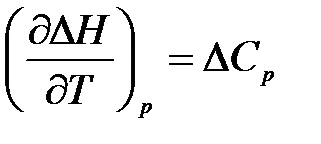
A kémiai reakció egyenlő
.
Hasonlóképpen a folyamatok előforduló V = const,
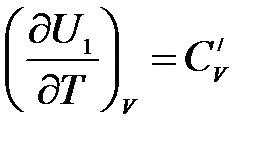
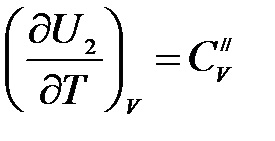
A kémiai reakciók
.
Az így kapott egyenlet (1.13) és (1.14) kifejezni Kirchhoff-törvény:
Hőmérsékleti együttható meleg hatása a kémiai reakció (vagy más folyamatok) előforduló ha p = const vagy V = const a különbség termikus kapacitások a rendszer a kezdeti és a végső állapotban.
Elemezzük a Kirchhoff egyenlet.
Az egyenletek az következik, hogy a hőmérséklet hatását a termikus hatása határozza meg a jele:
- ha # 916; Cp> 0, a származék
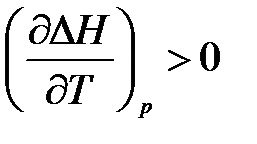
- ha # 916; Vö <0, то производная
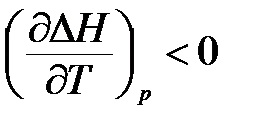
- ha # 916; Cp = 0, akkor a reakcióhő nem függ a hőmérséklettől.
Kirchhoff törvény lehetővé teszi, hogy kiszámítja a reakcióhő hatások bármilyen hőmérsékleten.
Egy egyenlet kiszámításához a termikus hatás előforduló
p = const. Mi választja el a változók az egyenlet Kirchhoff:
.
Amikor integráló Kirchhoff egyenlet gyakran hőmérsékletfüggése fajhője, mint a hatalom sorozat, amelyek érvényesek egy bizonyos hőmérséklet tartományban. A legtöbb esetben, az integráció végezzük bizonyos határokon belül, figyelembe alsó határa az integráció hőmérséklet 298 K, míg a felső - a hőmérséklet T. A reakcióhő 298 K könnyen kiszámításakor az első vagy a második törvénye vizsgálat Hess. Ennek eredményeként az integráció kapjuk:
Mivel izobár fajhő tulajdonságai állapot funkció # 916; Mi lehet írni:
,
,
,
,
.
Behelyettesítve a kifejezés # 916; Cp (1,15) és integrálása, kapjuk:
.
Ha a hőmérséklet-tartományban 298 K a T egyik reagenst változáson megy át az aggregált állapotban, vagyis fázisátalakulás megy végbe, a hőmérséklet-tartomány két részre van osztva időközönként: a 298 K Tf.p. (A hőmérséklet, amelynél fázisátalakulás történik) és a Tf.p. T:
.
Számítása a termikus hatás a Kirchhoff egyenlet nagymértékben egyszerűsödik, ha használat középen melegíti reagensek vagy fogadja, amely független a hőmérséklet ebben a tartományban.
Az egyenletek (1.16) a forma
.
A kifejezés zárójelben mindig állandó, így ebben az esetben a függőség hőmérsékletének hatása lineáris. A hátránya ennek a számítási módszert a termikus hatások az alacsony pontosságát.