Van der Waals-egyenlet
Hagyományos levezetése a Van der Waals
Az állam egy bizonyos tömegű bármely anyag lehet leírni három paraméter: nyomás \ (p \). mennyiség \ (V \) és a hőmérséklet \ (T \). Ezek a paraméterek vannak kapcsolva. Kapcsolatuk által leírt állapotegyenlet. amely általánosságban formájában: \ [F \ left (\ right) = 0. \] egy adott formája az egyenlet függ az anyag tulajdonságaival. Például hígított gáz kellően magas hőmérsékleten is jól leírták a modell egy ideális gáz. Állapotegyenlet számára köztudott Clapeyron egyenlet (\ (1799-1864 \)). javasolt \ (1834 \) által: \ [pV = \ fracRT \.], ahol \ (m \) - tömege a gáz, \ (M \) - moláris tömegét (azaz, súlya egy mól gáz) \ ( R \) - az univerzális gázállandó. Egy mól gáz, ez az egyenlet a következő alakú: \ [. PV = RT \] Végzett későbbi kísérletekben kiderült eltérést viselkedését valós gázok ideális gáz törvényeket. Ezeket az eredményeket össze a holland fizikus Jan Diederik van der Waals (\ (1837-1923 \)). amely \ (1873 \) felajánlották pontosabb állapotegyenlet egy igazi gáz. Úgy hívják az egyenlet van der Waals és per egy mol írva \ [\ left (>> \ right) \ left (\ right) = RT. \] Ez az egyenlet figyelembe veszi az erők a vonzás és taszítás között ható molekulák. A vonzóerő veszik figyelembe, mert a közeli fal hatása. Valóban, a részecskék a belső tartományban, az erő a vonzás más molekulák kompenzálják átlagosan. Azonban részecskék közelében az edény faláról bekövetkezik kompenzálatlan vonzóerő \ (f, \) és befelé néz, a hajó. Ez az erő, egyrészt, arányos a részecskék koncentrációja \ (n \) az edényben, és másrészt - arányos a részecskék koncentrációja a határréteg. Az eredmény: \ [f \ sim \ sim \ frac >>, \] ahol \ (n \) - molekuláris koncentrációja az edényben, \ (V \) - térfogat \ (1 \) mól gáz.
Ez a hatás a vonzás a molekulák a fal réteg csökkenti a nyomást a tartály falán. A formális átmenet Clapeyron egyenlet Van der Waals egyenlet, ez megfelel cseréje \ [p \ P + \ frac >>, \] ahol \ (a \) - faktor függően különösen gáz és az edény méreteinek.
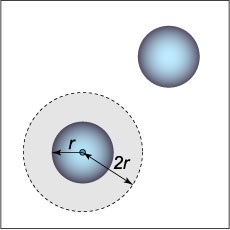
molekulái között a taszító erő a modell a van der Waals-erők veszik figyelembe, hogy nagyon egyszerű: azt feltételezzük, hogy a molekulák formájában sugarú gömb \ (r \), és nem került közel egymáshoz a központjai közötti távolság kisebb, mint \ (2r \.) Feltételezhető amely körül az egyik a két molekula, van egy "tiltott" (negatív vagy pozitív), a mennyiség (ábra \ (1 \)) egyenlő \ [\ frac \ pi \ right) ^ 3> = 8 \ cdot \ frac \ pi. \] Következésképpen, molekulánként kizárt térfogatát \ [= 4 \ cdot \ frac \ pi = 4, \] ahol \ (\) - a térfogata egy molekula.
Ennek eredményeként. ha egyenletben Clapeyron mennyiségben rendelkezésre álló hely a mozgás molekulák egyenlő \ (V, \) most lesz egyenlő \ [V - = V - b, \] ahol \ (\) - Avogadro-szám (megegyezik a molekulák számát egy gáz mól), \ (b \) - kizárt térfogat miatt taszítása molekulák.

Ábra 2 január Diederik van der Waals
Feltételezve, hogy a molekuláris vonzás és taszítás erők közösen és cseréje \ (p \) és \ (V \) új kifejezések, kapjuk a egyenletet Clapeyron egyenlet van der Waals: \ [\ left (>> \ right) \ left (\ right) = RT. \]
Izotermák van der Waals
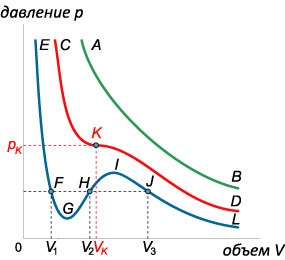
Állandó hőmérsékleten, a Van der Waals leírja a függőség \ (p \ left (V \ right). \) A sík \ (PV \) az ilyen függőség képviselteti magát, mint egy család izotermák. amelyek mindegyike megfelel egy bizonyos hőmérsékletet. Hogy tanulmányozza ezt a kapcsolatot, akkor átalakítja az egyenlet van der Waals-erők a következő formában: \ [>>> \ right) \ left (\ right) = RT \;> \ right | \ Cdot,> \; \; + A> \ right) \ left (\ right) = RT,> \; \; + AV - PB - AB - RT = 0,> \; \; - \ left (\ jobb) + av - AB = 0 \;> \ right |: p,> \; \; - \ left (>> \ Jobb) + \ frac
V - \ frac>
= 0.> \] Egy fix érték \ (p \) a kapott egyenlet egy harmadfokú egyenlet a változó \ (V \). Ismeretes, hogy a harmadfokú egyenlet lehet \ (1 \), vagy \ (3 \) valós gyöke. Az első esetben fordul elő magas hőmérsékleten \ (T \) (zöld izoterma \ (AB \) az ábrán \ (3 \)). Hőmérsékletének csökkentésével a izoterma jelenik hullámos része. Ebben az esetben a három gyökér (kék izoterma \ (EFGHIJL \)). Az átmenet a két típus között izotermák történik egy bizonyos hőmérsékleten \ (\) nevezzük a kritikus hőmérséklet.
> \ Jobb) + \ frac
V - \ frac>
= 0 \] kell írni \ [> \ right) ^ 3> = 0. \] Bővítés kocka különbség, és egyenlőségjelet együtthatóit mindenkori fok \ (V, \) található a kifejezéseket a kritikus paraméterek: \ [> \ right) ^ 3 > = 0> \; \; - 3 + 3V - V_K ^ 3 = 0.> \] Feltételezzük, hogy a kritikus pont \ (p = \), \ (T = \.) Ezért, kapjuk: \ [- \ left (>
> \ Jobb) = - 3 \\ \ frac >> = 3V_K ^ 2 \\ - \ frac >>> = - V_K ^ 3 \ end \ jobbra,> \; \ ;. b + \ frac>
3 = \\ \ frac >> = 3V_K ^ 2 \\ \ frac >>> = V_K ^ 3 \ end \ right ..> \] részben a harmadik egyenlet a második: \ [\ igényel >> \ cdot \ megszünteti >> = \ frac >>>>>,> \; \; . = 3b> \] határozza meg \ A második egyenletből (: \.) \ [= \ Frac >> = \ right)> ^ 2 = >>>> >>> \] Végül, az első egyenletből találunk kritikus hőmérséklet \ ( : \) \ [= \ frac - b> \ right) >>> = \ right) \ cdot \ frac >>>>> = >>> \.] tehát, a kritikus paraméterek a gáz a modellben a van der Waals erők függenek csak az értékeket \ (a, b \), és határozza meg \ [= 3b,> \; \; \; = \ Frac >>,> \; \; \; = \ Frac >>.> \] Megjegyzendő, hogy megtaláltuk a kritikus értékek használata nélkül származékok. Belátható, hogy a kritikus pont paraméterekkel \ (\) \ (\) \ (\) első és második derivált függvény \ (p \ bal (V \ right) \) nullával egyenlő (lásd a példa \ (1 \) ).
A fenti egyenlet az állami
A kritikus paraméterek a \ (\) \ (\) és \ (\), akkor lehet menni a dimenzió változók: \ [>>> \; \; \; >>> \; \; \; >>> \] és átírni az egyenlet a van der Waals-erők a redukált formában. \ [, \; P = \ pi, \; T = \ tau,> \; \; + \ Frac> \ right)> ^ 2 >>>> \ right) \ balra (- b> \ right) = R \ tau,> \; \; >>> + \ frac \ right)> ^ 2 >> >> \ right) \ left (\ right) = R \ tau \ cdot \ frac >>,> \; \; >>> \ right) \ left (\ right) = 8 \ tau> \] Ez az egyenlet. sokoldalúbb, mint az eredeti egyenlet van der Waals erők. Izotermákat különböző anyagok, szerint kialakított, a fenti egyenletben ugyanaz lesz az azonos értékeket \ (\ tau. \) Folyamatos különböző szerveket, melyek leírása az azonos adott paraméterek \ (\ pi, \) \ (\ varphi, \) \ (\ tau, \) nevezzük megfelelő államok. Ha bármely két test vagy bármely két anyagot kapnak azonos paraméterek, ezek azonos nagyságú és egy harmadik. Ez a sokoldalú tulajdonságot nevezzük a törvény a megfelelő állapotok. Vegyünk egy másik érdekes invariáns. Mivel a modell a van der Waals kritikus értékeket \ (\) \ (\) \ (\) lehet kifejezni csak a két paraméter \ (a \) és \ (b \) tudjuk, hogy a kombináció ezen értékek, a független az \ (a \) és \ (. b \) felírható a következő összefüggés: \ [>>>>> = >>>>>>>>> = \ cdot \ megszünteti \ cancelR >> \ megszünteti \ cdot 8 \ megszünteti >>> = >> \; \; \; \; \; \ ;. \ Frac >> R >>> = = 0,375> \] Ez az arány az úgynevezett kritikus tényező, és nem függ semmilyen jellemző értékeket olyan anyag, azaz invariáns mennyiség.Fázis átmenet „gáz-folyadék” állapotban, és a metastabil
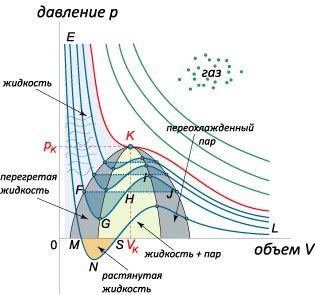
Tekintsük ismét az egyenlet a van der Waals-erők feletti hőmérsékleten a kritikus: \ (T 0, \), amely megfelel az instabil halmazállapot. A kis térfogatú fluktuáció \ (dV> 0 \) gáznyomás is növekedni fog (mivel \ (dp> 0 \)), ami robbanásveszélyes expandáló gáz. Ha negatív ingadozások \ (dV 0 \)) a tartományon belül által határolt spinodal. Kör közötti területen spinodal és binodal alapvetően megfelel a stabilitási kritérium \ (\ nagy \ frac >> \ normalsize 0.> \] Látjuk, hogy a diszkrimináns mindig pozitív, azaz egy másodfokú egyenlet két valós gyöke van kifejezve a következő képlet szerint :. \ [> = \ fracRT >>> \ right) >>> = RT >>> RT> \ right) >>> = RT >> \ right) >> RT >>.> \] Az első root \ (\) a mínusz jel a számláló nincs fizikai jelentése, mert \ (0 \) parabola megfelelő számlálójának a származék lesz irányítva ágak felett. Ezért a származékos amikor áthalad a megfelelő root \ (\) változtatja jelt plusz mínusz. Ez azt jelenti, hogy az a pont \ (\) a minimális függvény \ (pV: \) \ (=> \.)
Így, összenyomó rarefied gáz Van der Waals állandó hőmérsékletű terméket \ (PV \) első csökken, elérve egy minimális értéket \ (\ right) _>, \), majd emelkedni kezd. Az első szakasz annak köszönhető, hogy a dominancia a vonzó- a molekulák közötti, és a második szakaszban van társítva a megerősítése a hozzájárulás taszítóerők.Néhány gáz kellően alacsony értékeket Boyle hőmérsékleten. Például egy hélium \ (He \) azt \ (= 22,6 \; \ text \) neon \ (Ne \) ez egyenlő a \ (= 122,1 \; \ text \). Következésképpen szobahőmérsékleten hőmérsékletek ilyen gázok mutatnak monoton függőséget \ (pV \) a \ (V. \)