Kölcsönhatása molekulák (osztály 7)
- Nézz körül, és látni fogja a sok fizikai testek. Ez a szomszéd, akivel akkor ül az íróasztalnál, és a párt is. Ez a szék, amelyen ül, és tollak, hogy írsz, és így tovább .. Mindezek a testületek, mint már tudod, áll távközös-mi részecskék, amelyek folyamatosan mozog. Akkor miért a részecskék teszik ki a fizikai test. nem szórják minden Stora minket? Sőt, a test nem csak nem esik szét az egyes mol-Kula - éppen ellenkezőleg, hogy nyúlik, szünet, szünet, meg kell erőfeszítéseket tenni. Próbáld megérteni, hogy miért.
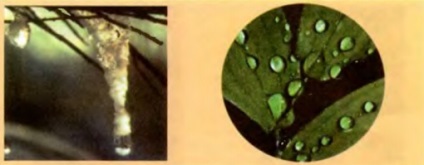
Ábra. 2.19. Függő vízcseppet eshessenek vonzóerők a molekulák között. Túl nehéz csepp esik
1. megerősíti a kölcsönhatás a molekulák
Ennek az az oka, hogy az összes szervek körülöttünk nem bontani egyes molekulák. Oche látható: molekulák vonzzák egymást. Minden molekula vonzódik a szomszédos molekulák, és azok viszont - neki. Names, ám a intermolekuláris vonzás szilárd megtartják alakjukat, a folyadékot összegyűjtjük a cseppecske (ábra. 2,19), egy ragasztószalaggal beragadt, a papír, a festék nyomot hagy a lapon, préselt egymáshoz szeleteket vezethet Qi Lindgren szilárdan megragadható (Fig. 2.20 ).
A tudomány is megállapította, hogy a vonzás a molekulák közötti csinálni mindig hatékony. Akkor miért nem válik egy törött csésze egész falu le, hogyan a törmelékek lenyomja a Dru-gu? A bármilyen erőt mi is összenyomjuk rész törött ceruza, így nem egyesülnek egy ceruzát.
Az a tény, hogy a vonzás között mo-molekulák észrevehetővé válik csak nagyon rövid távolságokra (pl amely méretéhez képest a saját ellenőrzés). Szorongatva csésze vagy töredékei a törött ceruza, mi hozza a ta-Kie távolság csak egy nagyon kis számú molekulát. A távolság a legtöbb olyan, hogy a molekulák nem praktikus-idézésben kölcsönhatásba lépnek. Most már világos, hogy miért, hogy ólomhengerrel gubancos, adott esetben előre séta csiszolva szeletekre darab lágy viasz és az agyag és összeragadnak egyszerűen nincs csiszolás.

Ábra. 2.20. Préselt egymáshoz vágott ólom rudak összeragadnak annyira szorosan, hogy viseli a súlyát a nagy súlyok

Ábra. 2,21 megkísérli annak kimutatását, intermolekuláris vonzásviszonyokat
Két száraz lapok lehetetlen, hogy húzza össze, hogy azok csatlakoztatva-lis. Azonban, ha nedvesítsük meg a lapokat vízzel, összetapadnak, mint Molek Proceedings of the vízmolekulák megközelíteni a papírt, hogy az intermolekuláris vonzás már rendelkeznek a lapokat egymás mellé (ábra. 2,21).
Intermolekuláris vonzás is az oka a nedvesítő- vagy nestachivaniya bizonyos testnedvek (ábra. 2,22).
2. Megerősítjük az intermolekuláris taszítás
Fent beláttuk, hogy van egy vonzereje a molekulák között. Ezt szem előtt tartva, számos kérdést. Miért van a gázmolekulák. zűrzavar mozgó és folyamatosan ütközik egymással, nem ragadnak össze egy nagy csomót? Miért, mikor nyomja, mint a szivacs, ez a neko-adott idő alatt helyreállítani a formája?

Ábra. 2.22. vízcseppecskék terjed ki a tiszta üveg felületén (ez nedvesíti), mint prita feszültségű molekulái között a folyadék nagyobb, mint molekulák között, a folyadék és az üveg (a). Vonzás, vízmolekulák között nagyobb, mint a molekulák közötti víz és a zsír, amelyet borított toll vízimadarak, így a víz nem nedvesíti őket (emlékszik a kifejezést „mint a víz le egy kacsa”) (b)
A tény az, hogy a molekulák nem csak vonzzák egymást, de taszítják. Ha a távolság közöttük lesz nagyon kicsi (nem-sokkal kisebb, mint a méret a molekula), az intermolekuláris taszítás száz novitsya erősebb, mint a vonzás. Próbálja tömöríteni, például az én-Netcom. Ön nem lesz képes jelentősen csökkenteni a méretét, mivel a molekulák érmék taszítják egymást. Is, akkor nem lesz képes, hogy jelentősen csökkenti a folyadék térfogata még a segítségével egy erős sajtó.
Ez az intermolekuláris vonzás és taszítás megtartja a molekula mo-folyadékok és szilárd anyagok egy többé-kevésbé specifikus távolságokat, hogy közelítőleg egyenlő a méret a molekulák maguk. Abban az esetben, csökkentve a távolságot molekulák elkezdenek taszítják egymást, míg a növekvő - vonzott annyira közel egymáshoz mind-CIÓ, és elhatárolja molekulák kell törekednie.
A molekulák kölcsönhatásba lépnek egymással: azok egyidejűleg vonzza és taszítják. Az intermolekuláris kölcsönhatást mutat Xia távolságokban, amely össze lehet hasonlítani a méret a molekulák maguk.
1. Miért szilárd és folyékony nem bonthatók egyes molekulák?
2. Milyen feltételek jelent a vonzás a molekulák közötti észrevehetővé válik?
3. Milyen feltételek mellett van taszítás, a rendelkezésre álló molekulák?
4. Miért nem tudok csatlakozni két darab tálak-ki, még akkor is erősen nyomja őket egymáshoz, és a két darab gyurma könnyen összetapadnak?
5. Ismert, hogy van egy vonzás között a molekulák. Akkor miért a molekula, például nincs levegő-Saját rayutsya egy helyen?
1. Hogyan gondosan lehet, hogy csatlakozott a két darab a sorból, nem kapcsolódik. Ebben az esetben miért nem érinti a vonzerejét MO molekulák?
2. Miért megtörni a húr, akkor kell erőfeszítéseket tenni?
3. Mi a célja az úsztatott üveg tárolása proklady-vayut papírszalag?
4. A folyékony ragasztót egy erős kapcsolatot a két test. Magyarázd-onok, úgy, hogy ez történik.
5. Melyek a hasonlóságok és mi a különbség a folyamatok hegesztés és forrasztás?
6. A tollat vízimadarak borított vékony zsírréteg. Milyen előnyökkel jár, hogy a madarak?
1. A lágy rugók (elasztikus vagy vékony), Me-net-fém (vagy üveg) lemez és egy tálka vízzel, pro azt mutatja, hogy a víz molekulák és fém (üveg), ott a gravitáció.
2. A papírlap tele növényi olaj és a víz, és kap választ ezekre a kérdésekre. Összetart, ha két lapot, ha nedvesítsük vízzel? olaj? ha az egyik megnedvesítjük vízzel, és a második tömeg-törmelék? Magyarázza meg a kísérlet eredményeit.
Ha javításokat és javaslatokat a leckét, kérjük lépjen kapcsolatba velünk.
Ha azt szeretnénk, hogy a többi beállítást és javaslatokat órák, nézd meg itt - Oktatási fórum.