Gyenge és erős elektrolitok
Mivel a mértéke elektrolitos disszociáció elektrolitos disszociáció - egy reverzibilis folyamat, valamint azok ionok és molekulák jelen elektrolit oldatok. Más szóval, a különböző elektrolitok, az elmélet szerint a C. Arrhenius disszociál ionokra különböző mértékben. Súly bomlási (elektrolit erő) jellemzi egy kvantitatív érték - disszociációs mértéke. A disszociációs mértéke (# 945; a görög betű az alfa) - az aránya molekulák bomlott ionok (n), a teljes száma oldott molekulák (N):
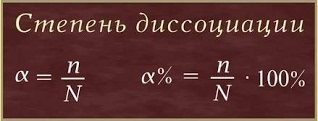
Az érték a disszociációs mértéke (# 945;)
1. Oldható sók; 2. Erős savak (sósav, HBr, HI, HNO3 NClO4 H2 SO4 (híg) ...); 3. Erős bázisok - alkáli.
1. Szinte az összes szerves sav (CH3COOH, C2 H5 COOH, stb); 2. Egyes szervetlen sav (H2 CO3 H2 S, stb ...); 3. Szinte az összes só vízben való oldhatósága alacsony, egy bázis és ammónium-hidroxidot (Ca 3 (PO 4) 2; Cu (OH) 2; Al (OH) 3; NH4 OH); 4. Víz.
1) Ha a kémiai fórum egyik diák írta: „Végre nem értem (ami meg volt írva), hogy miért nátrium-klorid oldattal bomlik Na + és Cl -. és nem a Na - és Cl + ». Hogyan magyarázza a szegény ember, mi folyik itt a megoldás? Milyen fontos része kémia idején, „séta”, a szerencsétlen iskolás?
Példák problémamegoldás:
Probléma 1. Határozza meg, milyen a disszociációs mértéke az elektrolit, ha 20 ° C-on minden 150 molekulák szét ionok 90. Egy erős vagy gyenge elektrolit?
Probléma 2. Határozza hány molekula disszociált az elektrolit oldatban, ha a disszociációs mértéke elektrolit 0,1, és az oldatot felvittük 3,01 • október 20-molekulák.
Feladatok önkontroll
1. Számítsuk ki a disszociációs mértéke bórsav H3 BO3. ha ismert, hogy az oldatban minden 500 molekulák szét ionok csak 40. Egy erős, közepes vagy gyenge szilárdsága az elektrolit?
2. Számítsuk hány molekula prodissotsiiruet elektrolit oldatban ki minden 120 molekulák, ha a disszociációs mértéke 95%.