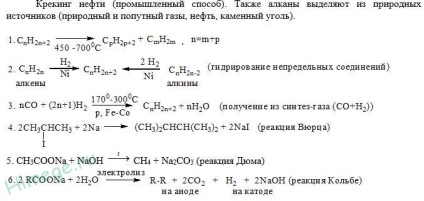
Alkánok - nómenklatúra, megszerzése, kémiai tulajdonságok
Alkánok - szénhidrogének, amelynek molekulái atomok kapcsolódnak egyszeres kötésekkel, és amelyek megfelelnek az általános képletű CnH2n + 2.
A alkánmolekulákat összes szénatomok sp3 hibridizációs állapotú. Ez azt jelenti, hogy mind a négy hibrid pályák a szénatomok azonos alakú, és az energia irányítani a sarkokban az egyenlő oldalú háromszög alakú piramis - tetraéder. Szögek között pályák 109 ° 28”.
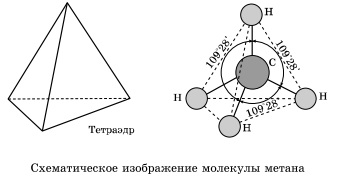
Körülbelül egy egyszeres szén-szén kötés lehet, gyakorlatilag szabad forgását, és alkánmolekulákat szerezhet a legkülönbözőbb alakú, sarkai a legközelebbi szénatomon a tetraéderes (109 ° 28 „), például n-pentán a molekulában.
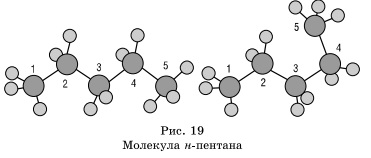
Érdemes felidézni a kötvényeket a molekulák alkánok. Minden kommunikáció az egységes molekulák telített szénhidrogéneket. Az átfedő zajlik a tengely
csatlakozott a atommagba, m. e. egy σ-kötést. A szén - szén apoláris és rosszul polarizálható. A hossza P-C kötést alkánok egyenlő 0154 nm (1,54 • 10 - 10 méterre). C-H kötést valamivel rövidebb. Az elektronsűrűség enyhén irányában mozdul el, elektronegatívabb szénatom, azaz. E. C-H kötés egy gyengén poláros.
A hiánya a molekulák telített szénhidrogéneket poláros kötvények vezet az a tény, hogy ezek gyengén oldódik vízben, nem lép kölcsönhatásba a töltött részecskék (ionok). A legjellemzőbb alkánok reakciók előforduló szabad gyökökkel járó.
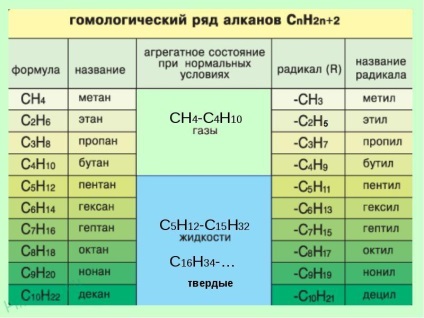
Homológ sora metán
Homológjait - olyan anyag, hasonló szerkezetű és tulajdonságú, és különbözhet egy vagy több CH2- csoport.
Izomériát és szakkifejezések
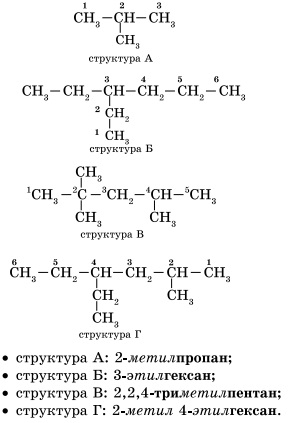
Az alkán jellemzi az úgynevezett szerkezeti izomerek. Szerkezeti izomerek különböznek a szerkezet a szénváz. A legegyszerűbb alkán jellemzi a szerkezeti izomerek - a bután.
nómenklatúra alapjai
1. Válogatás a fő áramkört. Képződése szénhidrogén nevek definiálásával kezdődik a fő áramkör - a leghosszabb lánc szénatomjainak a molekulában, amely egyfajta alapja.
2. A számozás a főlánc atomok. a főlánc atomok a hozzárendelt szám. A számozás a főlánc atomok indul a végén, amelyre az közelebb van a szubsztituens (szerkezet A, B). Ha szubsztituensek egyforma távolságban van a lánc végét, majd a számozás kezdődik a vége felé, ahol több (B szerkezetet). Ha különböző szubsztituensek egyforma távolságban van a végén a lánc, a számozás kezdődik a rossz végén, amely közelebb van a vezető (D-struktúra). Elsőbbség szénhidrogén szubsztituensek határozza meg, hogy milyen sorrendben következik a levelet az ábécé, amely kezdődik nevük: metil (-CH3), majd etil-(-CH2-CH3), propil (-CH2-CH2-CH3), stb ...
Felhívjuk figyelmét, hogy a nevét, a helyettes alkotja helyett az utótag -an utótag il a címet a megfelelő alkán.
3. Megalakult a cím. Elején a név jelzik szám - azonos számú szénatommal, ahol a szubsztituensek jelentése. Ha egy adott atomot több szubsztituenst, a megfelelő szám a címben kétszer megismételjük vesszővel elválasztva (2,2). Miután kötőjeles számok jelzik a szubsztituensek száma (di - két, 3-3, tetra - négy, penta - öt), és a neve szubsztituensek (metil, etil, propil). Ezután nincs szóköz vagy kötőjel - a név a fő áramkört. Főáramkör hívják, mint a szénhidrogén - tagja a homológ sor metán (metán CH4 Etán C2 H6 propán C3 H8 Bután C4 H10, pentán C5 H12 hexán C6 H14 Heptán C7 H16, oktán C8 H18, nonán C9 H20, dekán C10 H22 .....) .
Fizikai tulajdonságai alkánok
Az első négy tagja a homológ sor metán - gázokat. A legegyszerűbb közülük - metán - gáz nélkül színe, íze és szaga (illata „gáz” érzés, ami szükséges felhívni a 04 határozza szagú merkaptánok - kénvegyületek szándékosan hozzáadott metán használt háztartási és ipari gázkészülékek, hogy az emberek akik közel állnak hozzájuk, képesek voltak azonosítani a szivárgást szag).
Szénhidrogének a C4-C15 H12 H32 - folyadék; a nehezebb szénhidrogéneket - szilárd anyagok. Forráspont és olvadási hőmérséklet fokozatosan nőtt alkánok egy szénlánc hossza növekszik. Minden szénhidrogén gyengén oldódik vízben, folyékony szénhidrogének szokásos szerves oldószerek.
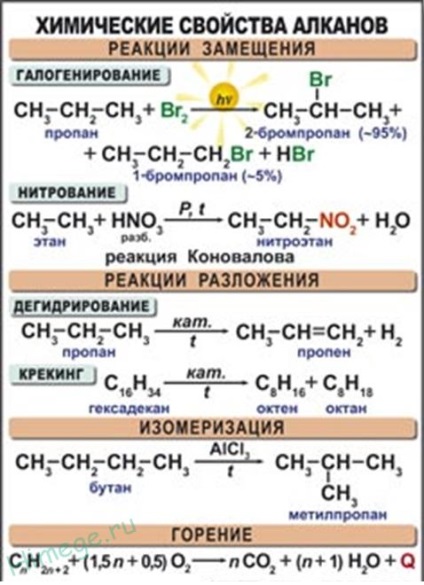
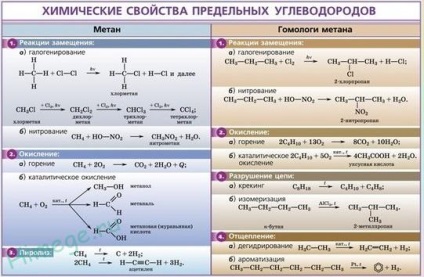
Kémiai tulajdonságait alkánok
szubsztitúciós reakció.
A legjellemzőbb alkánok gyökös szubsztitúciós reakció, amelyben a hidrogénatom helyén egy halogénatom vagy bármely csoport. Itt a karakterisztikus egyenlet halogénezési reakciók:

Abban az esetben, halogén feleslegének klórozás mehet akár teljes helyettesítés valamennyi hidrogénatomnak klór:
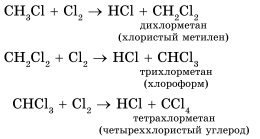
A kapott anyagok széles körben használják például oldószereket és kiindulási anyagok a szerves szintézisekben.
A dehidrogénezési reakciót (hidrogén absztrakció).
Az átvitel során alkánok a katalizátor felett (Pt, Ni, CR2 A12 03. 03) magas hőmérsékleten (400-600 ° C) a hidrogén molekula lehasad és a kialakulása alkén:
A reakciókat kísérik a pusztítás a szénlánc.
Minden telített szénhidrogének éget, hogy szén-dioxid és víz. Gáznemű szénhidrogének levegővel keveredve bizonyos arányban, felrobbanhat.
1. Égő telített szénhidrogének - exoterm gyökös reakció, ami nagyon fontos, amikor a tüzelőanyag-alkánok, mint:
Általában, az égési reakció alkánok felírható a következőképpen:
2. A termikus hasítást szénhidrogének.
A folyamat megy végbe a szabad gyökös mechanizmussal. A hőmérséklet növelése vezet homolitikus megrepedése szén-szén kötés, és a szabad gyökök képződését.
Ezek a gyökök reagálnak egymással kicserélésével hidrogénatom alkotnak egy molekula egy alkán és alkén-molekula:
termikus krakkolási reakciók hátterében ipari eljárás - szénhidrogén krakkoló. Ez a folyamat a legfontosabb szakasza finomítás.
3. A pirolízis. Hevítve metán hőmérséklete 1000 ° C-metán pirolízis kezdődik - bontás egyszerűbb anyagok:
Amikor hőmérsékletre hevítjük 1500 ° C, a kialakulását acetilén:
4. Izomerizáció. Melegítésre a lineáris szénhidrogének egy izomerizációs katalizátorral (alumínium-klorid) az anyagok kialakulását egy elágazó szénváz:
5. Az ízesítés. Alkánok hat vagy annál több szénatomot tartalmaz a láncban jelenlétében gyűrűzárási katalizátor benzol és származékai:
Alkánok lép reakciók halad keresztül egy szabad gyökös mechanizmussal, azaz. K. Összes szénatomot az alkán molekulák képesek sp3 hibridizációs. A molekulák ezen anyagok vannak felépítve útján kovalens C-C apoláros (szén - szén) kötvények és gyengén poláros C-H (a szén - hidrogén) kötések. Nem kell területeken, ahol magas és alacsony elektronsűrűség, könnyen polarizálható kötvények, t. E. ilyen kapcsolat, az elektronsűrűség, amely helyettesíthető hatása alatt a külső tényezők (elektrosztatikus mezők ionok). Következésképpen, alkánok nem lép reakcióba töltött részecskék, azaz. K. Alkánok kötések molekulák nem törnek meg heterolitikus mechanizmus.
Előállítási módszerei