Módszerek problémák megoldására a kémia, hogy módosítsa a koncentrációja az oldat, a kémia vizsga
A kapcsolatos problémák hozzáadásával oldatot egy bizonyos mennyiségű oldószer vagy oldott anyag, először ki kell számítania az az oldott anyag tömege a kiindulási oldatban, majd használni további számításokhoz. A feltétel az egyes feladatok az egyértelműség jobban képviseli, mint a minta.
1. feladat.
Ahhoz, hogy 180,0 g 8% -os nátrium-kloridot adunk hozzá, 20 g NaS1. A tömeghányada nátrium-kloridot a kapott oldatot. % (Lemezszám akár a tizedik).
adott:
tömeg törzsoldat: miskh.r-pa = 180 g;
NaS1 tömeghányada a kiindulási oldatban (NaS1) a p-D ref = 8%;
tömeg hozzáadott só NaS1: m (NaCl) adtunk = 20 g.
Keresés:
tömeghányada sót a végső oldatban: (NaS1) a con / p-D
megoldás:
Feltétel Probléma kényelmesen jelenik meg kép:
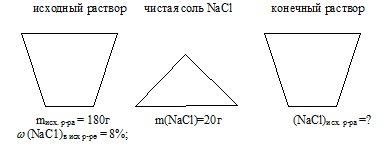
1. Egy sor NaCl a betáplált oldatban:
2. NaS1 súlya a végső megoldás az összege:
m (NaS1) a kon.r.re = m (NaS1) ref. r.re + m (NaS1) adtunk hozzá. 14,4+ = 20 = 34,4 g
3. A súlya a hozzáadott só, és figyelembe veszi a tömeg a végső oldat:
mkon. r-ra = miskh. p pa + m (NaS1) adtunk hozzá. = 180 + 20 = 200 g
4. A kapott adatok lehetővé teszik, hogy meghatározza egy tömeghányada a végső oldatban:
A feladat, amely bizonyos mennyiségű vizet adunk hozzá, hogy egy része ismert koncentrációjú, megoldódott ugyanazt az algoritmust használva.
A probléma a keverési két megoldást elvégzéséhez szükséges valamivel több számítást. Ebben az esetben ki kell számítani a tömeg az oldott anyag az egyes
Stock megoldásokat.
2. probléma.
Összekeverünk 200 g 20% -os NaOH-oldatot 218 ml 10% -os oldat ugyanazon anyag (p = 1,11 g / ml). Tömeghányadát alkálifém a kapott oldathoz. % (Lemezszám kell a legközelebbi tized).
adott:
első tömeg NaOH-oldat: M1 ref p-pa = 200 g;
frakciójának tömege NaOH az első p-D: w (NaOH) 1-D ref p = 20%;
térfogata a második oldat NaOH: V2iskh.r-pa = 218 ml;
frakciójának tömege NaOH-ot a második p-D: (NaOH) 2 ref. p D = 10%;
sűrűsége a második törzsoldat: ref p2. RR = 1,11 g / ml.
Find: tömeghányada NaOH a végső p-D: (NaOH) a késő r-re
megoldás:
Feltétel Probléma kényelmesen jelenik meg kép:
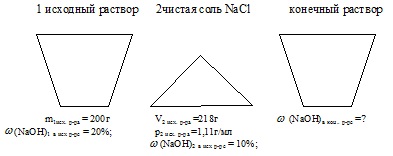
E probléma megoldásában szükség van, hogy meghatározzuk a tömegét NaOH mindegyik törzsoldatból. Ezután keresse meg a teljes súlya a végső tömege az oldat és a nátrium-hidroxid az ott. Ezután kiszámítjuk a kívánt értéket.
tükrözheti vázlatos algoritmus a határozat az alábbiak szerint:
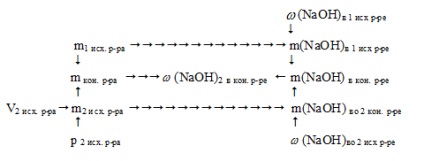
1. Egy sor NaOH az első betáplálási oldat:
2. Keresse meg a súlya a második törzsoldat:
m2 ref. r-Ra = V2 ref. p-pa. p 2 ref. r-Ra = 218 1,11 = 242 g
3. Keresse meg a súly NaOH oldatot a második forrás:
m (NaOH) a con. p D = m (NaOH) 1 ref. D-p + m (NaOH) 2 ref. p-D = 40 + 24,2 = 64,2 g
5. Keresse meg a súlya a végső megoldás:
mkon. r-Ra = m1 ref. rr + m2 és ref. r-Ra = 200 + 242 = 442 g
6. tömegére frakciót NaOH a végső oldatban:
Kerekítés a legközelebbi tized.
Válasz: (NaOH) kon.r-D = 14,5%.
A probléma megoldása a párolgás tömeges csökken általában miatt az oldószer eltávolítása. A oldott anyag tömege változatlan marad, ami a megnövekedett koncentrációja.
3. feladat.
Határozza meg a víz tömegét, hogy el kell párologtatni 2 liter 10% -os nátrium-hidroxid-oldatot (p = 1,11 g / ml), hogy fokozza a tömeghányad NaOH abban, hogy 15%. Válasz. g (rekord számú akár egész szám).
adott:
térfogatú törzsoldat: Viskh. r-Ra = 2 L;
sűrűsége törzsoldat: riskh r-Ra = 1,11 g / ml;
frakciójának tömege NaOH-ot a kiindulási p-D: (NaOH) r.re ref = 10%;
frakciójának tömege NaOH végső p-D: (NaOH) a p-con D = 15%
Find: sok vizet elpárologtatjuk: m (H 2 O) = bepároljuk?
megoldás:
Bepárlásával a vizes nátrium-hidroxid oldatot csak elpárolog a víz. NaOH tömege azonos lesz mind a kezdeti és a végső oldatot.
Vázlatosan döntési algoritmus leírható az alábbiak szerint:
1. Mi található a kezdeti tömege az oldat:
2. Find tömeg NaOH a betáplált oldatban:
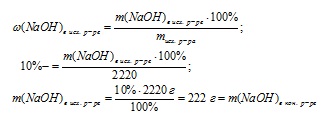
3. Határozza meg a végső oldat tömegét:
4. csökkentése oldat tömege csak a párolgás miatt a víz, ezért, a különbség a tömegek kezdeti és végső oldat tömegét megtalálható víz elpárologtatására:
m (H2 O) = miskh bepároljuk r-ra - mkon. r-RA = 2220 - 1480 = 740
Válasz: m (H 2 O) = 740 eltűnt
Bizonyos körülmények között a problémákat, feltételezhető Az oldat eltávolítása gáz formájában illékony oldott anyag (például NH3; HC1, H2 S feloldjuk vízben vagy egy szerves anyag). Ahhoz, hogy megoldja ezeket a problémákat úgy kell tekinteni, mint tömegállandóságig az oldószer (víz).
4. feladat.
Melegítés hatására, 200 g 25% -os ammónium-hidroxid-oldatot 20 g anyagot bepároljuk. A tömeghányada ammónia oldat előmelegítés után. % (Lemezszám akár a tizedik).
adott:
tömeg törzsoldat: miskh p-pa = 200 g;
NH 3 tömeg frakció a kiindulási oldatban (NH3) Ref. p D = 25%;
tömege illékonyabb ammónia: m (NH3) = 20 g. bepároltuk
Find: tömeghányada NH3 a végső p-D (NH3) összefüggésben. p = D?
megoldás:
Vázlatosan döntési algoritmus leírható az alábbiak szerint:
1. Egy sor NH3 a betáplált oldatban:
2. Egy sor NH3 a végső oldatban:
Egy sor végső oldat 1:
4. Find tömeghányada az ammónia a végső oldatban:
Kijelzett érték, által előírt feltételek, és azt kapjuk (NH3) összefüggésben. p D = 16,7%.
Válasz: (NH3) keretében. p D = 16,7%.
- Ön itt van:
- legfontosabb
- feladatok
- EGE-kémia
- Meghatározása a tömeg és a móltörtje egyes só a keverék | Feladatok 33-34