Meghatározása elemi elektromos töltés elektrolízissel tartalom platform
Elektromos töltés ELEKTROLÍZISSEL
Berendezés: egy áramgenerátor, egy cella elektródái egy sor „elektrolit” laboratóriumi voltmérő, ellenállás mérlegek tömeggel vagy elektronikus kulcs, csatlakozó vezetékek, oldott réz-ku Poros, stopperórát (vagy egy órát egy második kézzel).
KIEGÉSZÍTŐ dolgozni. használhatja a Faraday-törvény elektrolízis meghatározására az elektron töltése, ahol m - az anyag tömegét felszabadult a katód; M - moláris anyag tömege; N - vegyértéke az anyag; e - a töltés egy elektron; Na - Avogadro-szám; I - áram az elektrolit; # 8710; t - idő átfolyó áram az elektrolit.
Ebből a képletből kitűnik, hogy a cél a munka, amit tudnia kell mo moltömegére anyag felszabadította a katód, a all-in és egyenértékűségét az Avogadro-állandót. Ezen túlmenően, a kísérlet során, meg kell mérni az erő a jelenlegi és az ennek megjelenési ideje, és miután az elektrolízis - sok anyag felszabadulását a katód.
A kísérletekhez egy telített vizes réz-szulfát, amely öntenek a cella kételemű réz ktrodami. Az egyik elektród van mereven rögzítve a közepén a sejt, és a másik (levehető) -, a falán.
A vizes oldatot disszociált molekulák nem csak a réz-szulfát (CuS04 = Cu2 + +), hanem a víz (H20 = H + + OH -), bár kisebb mértékben. Így, vizes CuS04 tartalmazó oldatban pozitív ionokat a Cu2 + és H + és a negatív ionok OH- és SO 2-. Ha az elektródák között, hogy hozzon létre az elektromos mező, a pozitív ionok fog mozogni a katód felé, és a negatív-WIDE - az anód. A katód alkalmas ion Cu2 + és H +, de nem mentesíti mindet. Ez azért van, mert a réz atomok és a hidrogén könnyen át egy pozitív töltésű ionok, elveszítik a külső elektronok. De rézion könnyen tulajdonít elektron, mint az ion-víz faj. Ezért, a katód kisülés rézionok.
A anód fog mozogni a negatív ionokat és OH, de egyikük sem nem sülnek. Amikor ez oldódni kezd a réz-Xia. Ez azért van, mert a réz atomok könnyebben adományoz elektronok egy külső elektromos áramkör részét, mint az ionok és az OH -, és válik a pozitív ionok át oldatba: Cu = Cu2 + + 2e-.
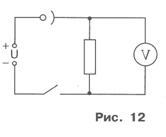
Annak érdekében, hogy a kicsapott réz- réteg sűrű és jól tartottuk a katód, elektrolízis ajánlott kell végezni, nem nagy áram erőssége az oldatban. És mivel ez azt eredményezi, hogy nagy mérési bűnössége helyett az árammérő a laboratóriumban az ellenállással és voltmérővel. A jelzést a voltmérő U és co-rezisztenciát R ellenálláson (úgy tűnik, a testén) határoztuk meg a B-lu áram I / sematikus diagramja a kísérleti elrendezés látható a 12. ábrán.
A jelenlegi az elektrolit a kísérlet során is változhat, ezért a képlet meghatározására töltés al-stavlyayut 1SR a középérték. Az átlagos áramerősséggel határozza felvétel minden 30 másodpercben egy voltmérőt leolvasott Hossz-SRI teljes megfigyelési időszak, majd az összegük-miruyut, és a kapott értéket elosztjuk a mérések száma. Így talál UCP. Majd Ohm törvénye az részáramkörnek vannak lep. Vo jég-B feszültség mérések könnyebb, hogy kisérő-ing táblázatban.
áram mért idő stoppert.
Előállítás ÜZEMBEHELYEZÉSÉT
1. Határozza meg, milyen fizikai mennyiségek vannak kitéve közvetlen mérés meghatározására elektron töltése módszer ebben a munkában. A rendszer segítségével a néhány eszköz kell mérni? Határozza meg és rögzíti a határokat abszolút pogreshnos-mekek ezeket az eszközöket.
2. Határozza meg, és rögzítse az határait abszolút hibát, hogy referenciának egy mechanikus stopper, voltmérő és súlyok.
3. Írj egy képletet meghatározó határait abszolút bűnös-ség # 8710; e.
4. Készítsen egy táblázatot, amely rögzítené a mérési eredmények és a hibák számításigényes TIONS.
Készítsük el a kiegészítő tábla rögzíti a vallomását aktuális méter.
Válaszolj a kérdésre
Miért van az ideje folyik áram az elektrolit befolyásolja a bűnös-ség mérés eredményét az elektron töltése?
Ahogy a koncentrációja az oldat befolyásolja a mérés eredményét az elektron-sorozat?
Mi a vegyérték réz?
Mi moláris tömege a réz?
Mi az Avogadro-szám?
ORDER TELJESÍTMÉNYÁLLANDÓSÁG
1. Határozza meg a súlyt a mérleg kivehető elektród T1.
2. csatolása az elektródát a cellában, és össze az elektromos áramkört úgy tűnt, a 12. ábrán Figyeljük meg, hogy az elektróda egy levehető Xia csatlakozik a negatív pólus a feszültségforrás.
3. Töltsük a küvetta oldattal réz-szulfát, zárja le a kulcsot, és 30 másodpercenként 15 percig rögzíti a bizonyságot a jelenlegi méteres.
4. 15 perc elteltével nyissa ki a kulcstartó szét, és távolítsa el az elektróda, és meghatározzák annak száraz tömegét m2 réz rakódik rá.
5. Számítsuk ki a súlya a kicsapott réz-: t- külföldön és ab abszolút hiba a mérési # 8710; t.
6. Kiszámítjuk az átlagos értéke a feszültség az ellenálláson Usr és az átlagos áram az elektrolit Wed.
7. Compute e az elektron töltése.
8. Kiszámítjuk határ abszolút hiba meghatározása elektron töltése # 8710; e.
9. Vedd a meghatározott eredmény a töltés a határokat az abszolút hiba.
10. Hasonlítsa össze az elektron töltése, határozza meg a kísérlet eredményeit lefolytatott-CIÓ, a táblázatos érték.