A polaritás a kötvények szerves molekulák
Egy összehasonlítás a dipólusmomentum a kötvények az következik, hogy minél nagyobb a polaritása a kapcsolat, annál nagyobb a különbség a electronegativities az atomok alkotó kötést.
A kivétel a C-kapcsolat OIC-S, C-FIC-Cliz az erős növekedése kötéshossz a átmenet az elemek a 2., hogy az elemek a 3. időszak:
1,1D <1,56D 1,83D <2,05D
A dipólus momentum a többszörös kötések nagyobb, mint a megfelelő közönséges:
A dipólusmomentumának többszörös kötés
A következtetés, hogy az irányt a dipólus momentum levezethető adatok electronegativities az atomok komponensek: az atom, amelynek villamosan kisebb, pozitív vége a dipólus. Ez a szabály azonban nem mindig figyelhető meg a konjugált (aromás) rendszereket.
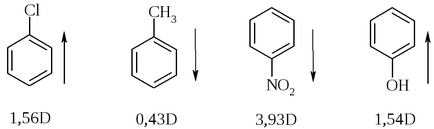
Az összeg a dipólus momentum az irányt a kötés vonalat lehet használni összehasonlító minőségi értékelést kapcsolatok polaritású (relatív polaritását).
Tört vagy részleges töltés
A szerves kémiában gyakran használják a „részleges töltés”, „frakcionált díj.” Részleges töltés - az aránya elektronok atomonként kap:
ahol L - internukleáris távolság (hossza kovalens kötés), l - távolság a középpontok között az egyes díjak dipól, · e - a mennyisége a részleges töltés.
Ez az arány a minőségi, mert nem veszi figyelembe a növekmény be dipólmomentum miatt magányos elektronpár.
induktív effektus
Induktív hatás (azonos hatást a különböző tankönyvek is nevezik elektronikus vagy poláris) - képes továbbítani a befolyásukat helyettes a lánc kovalens kötéssel atomok. Ebben az esetben a helyettes is tapasztalható a hatása a fennmaradó molekula, amelyhez kapcsolódik.
Átviteli hatást szubsztituens vonalon vagy σ- -kötések megváltozásához vezet az elektronikus állapotában ezek a kapcsolatok: a polarizációs, amely különbözik attól függően, hogy milyen típusú kommunikációt.
σ-kötést. Van egy fokozatos csökkenését változás az elektronikus kapcsolatok helyzetéről:
Polarizációs kapcsolat a klórt és a szénatomok okoz indukciós (induktív) polarizációs szomszédos C-C kötés; Helyettes ugyanakkor azt mutatja, -Iinduktivny hatást. A legnagyobb hatás nyilvánul stepeniI szomszédos szubsztituens a kapcsolatot. A növekedés a lánc indukciós lebomlik gyorsan.
-kötések. I-hatás polyarizatsii-felhők. Ez igaz izolirovannyh kötvények.
Ha a szubsztituens ionos töltések vagy dipólusok, elektrosztatikus kölcsönhatás lehet végezni nem csak a kommunikációs vonalak, hanem közvetlenül egy térben, vagy oldószer-molekulával. Ezt a hatást nevezzük a térvezérlésű szubsztituens (F-hatás). Sok esetben ez sokkal fontosabb Chemi hatást. Vértes mind a két hatást nehéz szétválasztani, és gyakran hozta össze a cím alatt „sarki hatás”, „elektronikus hatás”, vagy használja a „indukciós hatása”, „mező hatás” utalva az egyidejű hatása mindkét hatást. Hatása szubsztituensek a leválasztott helyzet (1,4 vagy több) csak elhanyagolható mértékben vezetéken keresztül a kapcsolatok és többnyire csak a befolyásolni a térben.
Polar hatások szubsztituens egy jól definiált értéket, intézkedés fennállása függ strukturális tényezők jelenlétét és jellegét a többi szubsztituens a molekulában, az oldószert és a többiek. Kvalitatív értékelése I-hatás jön létre, hogy összehasonlítjuk a hatása szubsztituensek a kémiai, fizikai-kémiai, (ionizációs állandója ) vagy fizikai (dipólus momentum NMR) tulajdonságait szerinti vegyületek a természete és mérete a standard szubsztituens - a hidrogénatom: összehasonlítja a vizsgált soedinenieR-X (a C-X kötést) és a standard soedinenieR-H (A C-H kötés). .. Ebben az esetben, a polaritás a C-H nullára van állítva, azaz, hogy nem veszik figyelembe a kis dipólus momentC-H = 0,2-0,4D.H- szabvány, a referenciapont; itt jön a gondolat, hogy a donor és akceptor ezt.
Ha a szubsztituens összehasonlítva hidrogénnel növeli az elektronsűrűség a atomos láncot (beleértve csökkenti rendelkezésre ott hatása alatt más atomok pozitív töltések), ez az úgynevezett elektrondonor szubsztituens (+ I-szubsztituens), és mutat + I-hatás.
Ha a szubsztituens összehasonlítva hidrogénnel húz az elektronok és a lánc atomok pozitív töltésű (vagy van egy csökkenése a negatív töltés áramkör, ha ez volt a bevezetése előtt a szubsztituens), ez az úgynevezett egy elektronszívó szubsztituens (-I-szubsztituens) és kiállítási -I -effect.
Valójában, nincs visszaút, nincs elektronbefogás nem fordul elő, de a különbségre utal abban a helyzetben, az elektronok szomszédos a helyettes, összehasonlítva hidrogén szubsztituens lehet:
: H-CH 2-Ph
Ha a hatása a helyettes továbbítjuk csak mintájára kommunikáció, az lenne várható, hogy a elektronegatívabb helyettesítő. található egy szénatomján keresztül a lánc, annál inkább a polarizáció kapcsolatok és a nagyobb hatást -I-szubsztituens:
Induktív hatások a különböző csoportok között a hidrogéngáz
Félig kvantitatív értékelése indukáló hatása
1) Eljárás dipólus momentum. De ha a szubsztituensek különböző atomok magános, akkor ez a módszer nem használható, mint
Érték szerint μnelzya arra következtetni, hogy a megjelölés a poláris hatása.
2) módszer ionizációs állandója. Minél több szubsztituens -I-hatás, annál inkább delocalizes töltés az anion, annál stabilabb a nagyobb az anion és a Ka (pKa értéke kisebb).
Selejtező induktív hatását szubsztituensek ionizációs állandója szubsztituált ecetsavak
X-CH 2 COOH X-CH2 COO + H
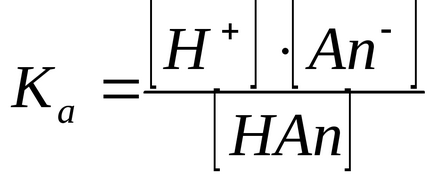
3) Eljárás Az NMR-spektroszkópia. Lehetővé teszi, hogy értékelje a relatív értékei pozitív töltés a molekulában CH3 X: gyengébb, mint a mező jelet eltoljuk protonjai metilcsoport, annál dezekranirovano mag, azaz a több levont következtetéseket vegyérték elektronok ... Sőt, van egy jó összefüggés a kémiai eltolódás és elektronegativitás.
Összehasonlítás töltött és nem töltött szubsztituensek
Töltésű atomok (csoportok) mutatnak erősebb -I-hatása, mint a töltés nélküli:
A negatív töltésű atomok (szubsztituensek) hatást mutat ellenkező előjelű, mint az azonos atomok (szubsztituenseket) egy töltés nélküli állapotban:
A negatív töltésű atomok + I-hatás nagyobb, minél kisebb a eiektronegativitás azaz kevesebb, mint a felelős az atommag közötti időszakban ..:
és annál nagyobb a töltés a sejtmagban és sugara az atom a csoportban:
A szénhidrogén (alkil) csoport + I-hatás növekszik a sorozatban:
-I-hatás növekszik ugyanabban a sorban, amelyben a elektronegativitási növekszik hibridizált szénatom:
-I: SP 3 t. e. a nagyobb aránya s-pályák, a több negatív indukciós hatásának. Az általános hatása szubsztituensek az állam σ-kötések általában elhanyagolható, és általában nem mutatjuk be külön a képletekben.