Meghatározása oxidációs potenciálját az oldat

Home | Rólunk | visszacsatolás
A természetes vizek nem egy, hanem több redox reakciókat. Ezek a reakciók a jelenléte elemenov amelyek képesek megváltoztatni a töltés függvényében elektromos potenciál az oldat. Ezért, a redox potenciál az oldat egészére meghatározzák a jellege és koncentrációja ezen elemek. Ezeket az összetevőket, amelyek jelentősen befolyásolják a redox potentsialrastvora nevű elektromosan. Elemek, a koncentráció és a létezési forma, amely ténylegesen vezérli az oxidációs-RECOVER-feno- lehetséges megoldás, az úgynevezett potenciális kap. A természetes vizek, így lehet O, S, C, N és Fe. Megoldások, amelyek viszonylag nagy koncentrációban ilyen összetevők, és így szinte semmilyen változás értéke oxidációs-RECOVER-kérelmező-CIÓ kapacitás hozzáadásával oxidáló vagy redukáló szerekkel, úgynevezett redox pufferek.
A redox-potenciál a megoldás egészére lehet meghatározni három módja van:
1- koncentrációk az egyes komponensek a redox pár,
2- közvetlenül egy standard hidrogén elektród, és a
3. a relatív tartalma elektroaktív komponens az oldatban.
1. Az első esetben, a redox potenciál határozza meg a relatív koncentrációi komponenseinek egy pár rodeks. Tipikusan ilyen pár közül választott az átmenetifémek, leggyakrabban Fe 3+ és Fe 2+. Ezek a fémek nem mindig lehetséges, hogy kérje, de ezek viszonylag gyorsan eléri egyensúlyi koncentrációja határozza meg oldatot Eh értéket. Ez a módszer Eh értéke értékelési példában mutatjuk be a II-6.
A friss vizet találtak 10 -3.3 mol / l Fe 2+. és 10 -5.9 mol / l Fe 3+. Meg kell határozni az értékét Eh megoldás.
Tegyük fel, hogy a vas koncentrációja ionok egyensúlyban. Ezek kölcsönhatásba szerint fél reakció: Fe 3+ + e - = Fe 2+. A standardpotenciál E reakció 10. lg KFE = -13, ze = 1. A friss víz aktivitása együtthatókat lehet azonos az 1.
Két lehetséges megoldásokat.
1. módszer: Ha az egyensúlyi egyenlet érvényes:
.
Aztán. Eh = 0,059 # 8729; 10,4 = 0,61 V.
2. módszer: szerint a Nernst-egyenlet
= 0,771- 0,059 lg (10 -3.3 # 8729; 10 +5,9) = 0,77- 0,15 = 0,62 A
Következésképpen a víz egy redox-potenciálja 0,62 V, amely 0,15 V-os alacsonyabb, mint a szükséges egyensúly. Ez a megoldás megy elektron-hiány az oxidálószer.
Azonban redox reakció lezajlásának különböző sebességgel az oldatban, amelynek értéke gyakran attól függ, a tartalom és a természet a mikroorganizmusok. A leggyorsabb tekinthető közötti redox-reakciók a fémek (például Fe 2+ 3+ ↔Fe. ↔Sn Sn 2+ 4+, stb), a felezési időt percekben vagy óra. Redox reakciók anionokkal, különösen a szerves anyagok bevonásával O2 és hidrolízis jóval lassúbb. Ez annak köszönhető, hogy az a tény, hogy ezek a reakciók magas aktiválási energiák, amelyek kapcsolatban vannak a pusztítás erős kovalens kötés. Sok ilyen redox folyamatokat a természetes körülmények között valósítják csak biokémiai katalízissel (például N2 → NO2 - → NO3 -). A sebesség ezek az eljárások nagyon alacsony és bizonytalan: mikrobiális populációk kell alkalmazkodni a környezet és a lép közvetlen kapcsolatba a redox pár. Csak a szulfid kén oxidációs lúgos környezetben annak tulajdonítható, hogy a viszonylag gyors folyamat. Sok redox reakciók túl lassú, mivel a rendkívül magas egyensúlyi állandók és lényegében visszafordíthatatlan. A felezési idő az ilyen reakciók több év is lehet. Erre különösen értékesek Eh Redoxpár ritkán lehet kritériuma a redox potenciál az oldat egészére.
Azonban, ezt a módszert alkalmazzák, hogy meghatározzák a redox potenciál értékét pufferrel, ami tipikusan kifejezze a nagyságát az egyensúlyi oxigén fugacitás. Ebben az esetben, oxigént alkalmazunk egy elektron donor redoxireakcióban. Ezután a reakció oxidációs a vas a következő:
és az oxidációs kén:
Itt, az oxigén aktivitást alkalmazzák egy kijelző vagy index redox körülmények, függetlenül attól, hogy az oxigén a rendszerben, vagy sem. Egyensúlyi körülmények között, az utóbbi reakció aktivitás értékével kapcsolatban egyensúlyi állandó:
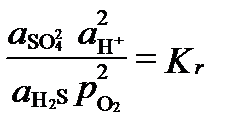
A redox potenciál ezen egyensúlyi helyzet fejezhető ki a mennyiséget oxigén fugacitás amely, amikor Kr = 10.126 és a pH = 7:
Jellemzően redoeks puffer kapacitása aránya határozza meg minearlnyh űrlap elemek különböző oxidációs állapotok. Az üledékes kőzetek, mint a index alkalmazott konverziós reakció a magnetit hematit:
Oxidatív körülmények szempontjából ülepedés és diagenesis harakerizuetsya oxigént fugacitás általában 0,2 atm a felszíni 10 -70 atm standard körülmények között.
2. meghatározása Eh az oldat felhasználásával a standard hidrogén elektród megbízhatóbb. Ebben az esetben, a redox potenciál közvetlenül határozzuk meg vízben, összehasonlítva egy standard hidrogén elektród potenciálját. amelynek nagysága Feltételezzük, hogy a 0. elektród ábrán bemutatott berendezést. II-8
Ábra II-17. Az elv oldatot Eh összehasonlítása standard hidrogén elektród potenciálja. A vizsgálat tárgyát a víz, B - egy standard hidrogén elektród.
Eh nagyságrendileg ilyen módon mért, jellemző eltérés átlagosan nem feltétlenül kiegyensúlyozott, épület # 8710; Erastv. oldatot teljes egészében a standard hidrogén elektród potenciál:
Meg kell jegyezni, hogy a tényleges potenciális a hidrogén elektród nem egyenlő 0-val a benne rejlő lehetőségeket alábbi egyenlet határozza meg:
Ha E 0 H = 0,0 V, a = 1 atm, akkor:
Activity együtthatóit hagyományos savak már jól tanulmányozták. Ezért hőmérsékleten 25 o C-on és 1 atm:
Ez az egyenlet jellemzi a korrekciót, ami általában automatikusan figyelembe veszi, és minimalizálja a hiba meghatározásában Eh az oldat pH-ja miatt a bizonytalanság a hidrogén-elektród.
Továbbá, amikor mérjük a Eh eletrodom kell vizsgálni a hatását kölcsönhatás az elektród oprobuemoy vízben, konkrétan annak korrózió vagy adszorpciós szemcsés anyag a felületén. Például, amikor elmerül anoxiás vízben gazdag Fe 2+ elektród O2 adszorbeált a felületén kicsapódhat FeOOH, amely jelentősen befolyásolja a electroactivity. Mérések elektród Eh legmegbízhatóbb módszer a tanulmány a savas víz magas koncentrációjú Fe 2+ és Fe 3+.
Értékek Eh, mért egy standard elektród tartalmaznak némi bizonytalanság. Nyilvánvaló, hogy a megoldások nagyobb nagyságrendű Eh működnek oxidáló tekintetében megoldások kisebb nagyságrendű Eh. De ez nem jelenti azt, hogy az összes redox reakció oldat egyensúlyi állapotban vannak, és ugyanazt az értéket a redox potenciál.
Emiatt, értékek Eh (PE), számított különböző rodeks-pár egyforma oldatot és az elektróda módszerek széles körű értékek. A legtöbb esetben, a kapott eredmények az elektróda, rossz eredmények hasonlóak kapott rodeks-párokat. Ez látható az ábrán II-9, ahol az értékek Eh, mért az elektróda módszer összehasonlítjuk azokkal az értékekkel a Eh, számítva rodeks-párokat.
A fő oka ennek a variáció az, hogy nincs természetes vizek a teljes egyensúlyi redox reakciók. Ezért értékeljük Eh elektród módszerrel, mint általában, nem tulajdonítható semmilyen konkrét redoxipárt és használt a kölcsönhatás értelmezésére összetevői. Kivételt az eset állhat fenn, amikor a használt elektród érzékeny csak egy rodeks pár. Ezzel szemben, Eh értéke, által kiszámított koncentrációja egyes redox párok lehet jellemzésére használjuk a redox potenciál az oldat egészére.
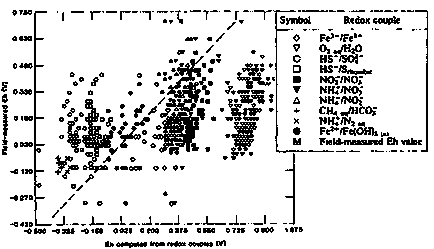
Ábra II-18. Összehasonlítása mező elektród Eh mérések talajvíz potenciálok által kiszámított egyes párok rodeks (Lindberg, R. D. Runnells, D. D. 1984).
3. Végül a redox-potenciál a megoldás lehet számítani, ha tudjuk, hogy minden Redoxpár összetételét, és hagyjuk a teljes kémiai egyensúlyt.
Valóban, ha J rodeks-reakciók, amelyek egyszerre, és megkövetelik, ve, J elektronok hatnak minden csere, a teljes elektronok száma részt vesz a redox-RECOVER-vi-ing oldatot folyamatokban is. Ezután a maximális hasznos munka minden galvanichesih nyomelem oldat egyenlet szerint II-149, egyenlő:
Ugyanakkor, a minimális szabad entalpiája összes ilyen reakciók, egyenlet szerint a II-91, egyenlő:
és ahol - értékeit a standard potenciálok moláris szabad entalpiája a reagensek és a termékek a redox reakciók - a minimális szabad entalpiája ezek a reakciók egyensúlyi, ve, J - elektronok száma részt vevő ezeket a reakciókat. Összehasonlítva az elmúlt két egyenletet, megkapjuk:
CO2 + 2H + + 2e = CO + H2 O (= - 0,104 V)
CO + 2H + + 2e = C + H2 O (= 0518 V)
CO2 + 4H + + 4e = C + 2H2 O (= (2 × 0,518-2 × 0,104) / 4 = 0,207 V)
A mennyiség jellemzi általános redox potenciál az oldat szempontjából a teljes kémiai egyensúly. Azonban ezt az egyensúlyt a természetes vizekben, mint általában, nem jár a nagy különbség a redox reakció sebességét. Tehát, hogy értékelje a valós értéket Ehrastv. Az oldatot figyelembe kell venni a valós aktivitás (koncentráció) szereplő komponensek redox reakciók ratvora. Ezután szerint az egyenletek II-150 és II-153 oldatot Eh általában: