Ionos kötés kialakulása reakcióvázlat - studopediya
Coulomb vonzóerő eredő kölcsönhatása töltésű ionok és jogszabály egyformán erős minden irányban. Ennek eredményeként ez az elrendezése az ionok a térben rendezett egy bizonyos módon, alkotó ionos kristályrácsban. Anyagok ionos KR normál körülmények vannak a kristályos állapotban, hogy van egy magas olvadási és a főzési hőmérséklet.
Fémek és ötvözetek kristályosodni formájában fém rácsok. Csomópontok egy fémráccsal által elfoglalt pozitív ionok a fémek. Vegyérték elektronok elválasztjuk a fématomok és a fennmaradó csomópontok a kristályrácsban ionok, többé-kevésbé szabadon a térben mozogni közötti kationok és hatására a villamos vezetőképessége fémek. Között az ionok és szabad elektronok keletkeznek elektrosztatikus kölcsönhatások, amelyek az oka a fémes kötés.
A fémes kötés van hasonlóságot mind ionos (következtében képződött közötti kölcsönhatás töltött részecskék: elektronok és ionok) és kovalens (bekövetkezik szocializáció elektronok, de ellentétben kovalens kötés, ahol az elektronok lokalizálódnak mintegy bizonyos atomok, elektronok fémeket megosztott minden kristály). Szabad elektronok néha elektron gáz.
Kationok fémes rácsok nincs transzlációs mozgás és oszcillálnak körül a helyzet a rács csomópontok. A amplitúdója e rezgések együtt növekszik a hőmérséklet, és amikor az olvadási hőmérséklet fém rács összeesik. Alacsony olvadáspontú fémek általában megnöveli a számát vegyérték elektronok az atomok.
Ezek közül kettő vagy több egyedi fém úgynevezett ötvözetek. A ötvözetek jelen lehetnek kis mennyiségben, és néhány nem-fémek (szén, kén, szilícium). A leggyakoribb módszer, hogy kapjunk egy közös fűtési ötvözetek azok komponensek, amíg a teljes olvadása a keveréket. Azonban néhány fémek nem egyesül egymással, minden tekintetben.
Fémötvözetek a következőképpen osztályozhatók: szilárd intersticiális oldatok (Part intersticiális üregeiben a rács által elfoglalt atomok más elemek, mint például a szénatomok a vas-vas és acél); szubsztitúciós szilárd oldatok (alapanyag részhez atomok atom helyettesít, a szennyező elem-ón forrasztási, 64 tömegrész ón és 36-ólom); keveréke kristályok az egyes fémek; keveréke kristályok intermetalicheskih vegyületek (kondenzált fémek alkotnak kémiai vegyületek jelen bronz Cu3 Sn vegyület)
Van der Waals erők - intermolekuláris erők (és atomközi) kölcsönhatás energia 10 - 20 kJ / mól. Ez a kifejezés az eredetileg kifejezés az összes ilyen erők a modern tudomány ez általában alkalmazzák a fellépő erőhatások a polarizációs molekulák és a kialakulását dipólusok. OtkrytyYa. D. van der Waals-1869-ben.
Van der Waals erők atomközi inert gázok hatására a lehetőségét aggregált Államok inert gázok (gáz, folyadék, szilárd testek).
A van der Waals-erők közötti kölcsönhatás dipólusok (indukált és állandó). A név abból ered, hogy ezek az erők okozzák korrekciókat a belső nyomás a állapotegyenlet egy igazi gáz van der Waals-erők. Ezek a kölcsönhatások és a hidrogén kötések, határozza meg a kialakulását a térszerkezet a biológiai makromolekulák.
Van der Waals-erők is merülhet fel a részecske (makroszkopikus részecske vagy nanorészecske), és egy olyan molekula, vagy két részecskéket
15. A módszer a vegyértékkötéseket. A fogalom a hibridizáció atomi pályák. A geometriája poliatomos molekulák: a modell Gillespie.
Módszer vegyértékkötés (MFR) más néven elmélete lokalizált elektron pár, mivel a módszer azon a feltételezésen alapul, hogy a kémiai két atom közötti kötést keresztül hajtjuk végre egy vagy több elektrondonor párokat, amelyek lokalizáltak túlnyomórészt közéjük. Ellentétben az IMO, ami egyszerűen egy kémiai kötés lehet egy kettős és egy multicentrikus, az MBC mindig két-elektron két központ és biztos. A számú elemi kémiai kötéseket, amelyek képesek képezni atom vagy ion, megegyezik annak vegyértékű. Csakúgy, mint a MMO, a kémiai kötés vegyérték elektronok vesznek részt. A hullám funkció állapotának leírásakor az elektronok képező kötés, az úgynevezett lokalizált orbitális (LO).
Megjegyezzük, hogy az elektronok által leírt LR szerint a Pauli-elv ellentétes irányú vissza, vagyis az MVS minden forog párosítva van, és az összes molekulák legyen diamágnesesek. Következésképpen MFR elvileg tudja magyarázni a mágneses tulajdonságait a molekulák.
Mindazonáltal, az elv a helyi kötvények számos előnnyel rendelkezik, amelyek közül az egyik - a rendkívüli tisztaságot. MIF kellően, például jósolja a vegyérték-atomok és geometriája a kapott molekula. Ez utóbbi annak köszönhető, hogy az úgynevezett hibridizációs AO. Úgy vezették be annak érdekében, hogy magyarázza azt a tényt, hogy a két-elektron két központ kémiai kötéseket rovására JSC különböző energia államok ugyanaz az energia. Így, BE * (2s 1p 1 1), B * (2s 2p 2 1), a C * (2s 2p 1 3) van kialakítva s - és p pályák, illetve két, három, vagy négy kötés, és ezért az egyik közülük meg kell erősebb, mint a másik. A tapasztalat azonban azt mutatja, hogy BeH2. BCI3. CH4 minden link egyenlő. A BeH2 kötés szög 180 °, a BCI3 - 120 °, míg a CH4 - 109 ° 28”.
A koncepció szerint a hibridizáció, kémiai kötések alakulnak vegyes - hibrid pályák (GO), amely egy lineáris kombinációja AO atom (ok - és p AOS BE, B, C), azonos energia és alkot egy specifikus térbeli orientáció (szimmetria ). Mivel az S - és p pályák adnak dvesp -edik szögben 180 ° egymáshoz képest.
Hibrid pályák és geometriája molekulák
Gillespie modell azon a feltételezésen alapul, hogy a kommunikáció végzi egy elektronpár, és a geometriai szerkezetét a molekulák / ionok határozza meg az összes elektron párok körülvevő központi atom. Ebben az esetben a következő szabályokat kell alkalmazni:
· Elektronikus pár osztatlan osztva, és körül vannak elrendezve a központi atom úgy, hogy azok taszítás minimális, azaz a maximális távolságra vannak egymástól
· Lone elektronpár foglal egy nagyobb térfogatú mint osztva
· Által elfoglalt térfogat kötő elektronpár kevesebb mint olshe elektronegatív atommal kötve egy központi
· Két elektron párokat kettős kötést vesz fel több, térfogata, mint egy pár egyszeres kötés
Hátrányok Gillespie modell
· D- alkalmazhatóságának a legtöbb vegyület, s-elemek
· A nem-alkalmazhatóságát vegyületek jelentős hányadát ionos jellege kommunikációs
· A képtelenség megjósolni a geometria a molekulák / ionok inert osztatlan elektronpárt
16. A módszer a molekulapályák. Alapvető fogalmak. Két-központ két-elektron molekulapályák. Energia diagramok Homonukleáris kétatomos molekulák kialakított elemeit az 1. és 2. kereteket. Mágneses tulajdonságok. A korreláció kommunikációs eljárások és az ionizációs energia. Egyszerű energia diagramok heteronukleáris molekulák (CO, HF, lítium-hidrid, H2 O).
A MOD-eljárás, feltételezzük, hogy a molekulában, mint egy atom, lehet építeni egy sor engedélyezett diszkrét energiaszinteket és a hullám megfelelő funkciókat őket (molekulapályák) viselkedését leíró egy elektron a molekulában. Minden energia szinten elhelyezhető legfeljebb két elektron. A konstrukció a hullám funkciók MO gyakran használják a atomi (AO), minden egyes leírja yi MO lineáris kombinációja AO (LCAO MO).
Kiválasztása egy ilyen képviselet MO fizikailag teljesen világos: a közelében minden mag-molekula elektron viselkedését hasonlónak kell lennie, hogy a leírt viselkedést az atom, és az atom ennek megfelelő SA. Ebben az esetben a közelítő megoldás (mert a molekulák Schrödinger-egyenlet megoldható csak hozzávetőlegesen!), Legalább ezeken a területeken lesz elég helyes. A régióban az atommagok Honvédelmi leírható szuperpoziciójával AO. A probléma megtalálásának MO hullám funkciókat ezáltal csökkenti a megállapítás az együtthatók. Ezen kívül meg kell határozni a megfelelő energia minden MO.
17. A hidrogén molekula és módszerek annak leírását. A módszer a kémiai kötés, molekulapálya módszerrel. LCAO kezelést. A átfedése atomi pályák, szigma és pi-kötés, a sorrendben (multiplicitás) kapcsolat. Kémiai kötés a H2 részecskék. H2 - H2 + és a helyzetét a Honvédelmi Minisztérium és a fegyveres erők módszerekkel.
18. A kémiai kötés Homonukleáris kétatomos molekulák elemeit a második időszak attól a ponttól, MO és VB módszerek. MO rendszer molekulák kezdete és vége a második időszakban. Sorrendjének megváltoztatása kapcsolat, kötési energia, kötéshossz az átmenet Li2 a NE2. Jellemzői B2 és O2 molekulák. A kötés erőssége a molekulában N2
19. Heteronuciear kétatomos molekula elemeit a második időszakban. MO áramkör HF, CO, CN, OF. Sun és az orbitális hibridizációs módszer. Vegyérték állapotban az atom. Típusai hibridizáció és térszerkezetének molekulák Gillespie.
20. kovalens kötések poliatomos molekulák. Donor-akceptor kölcsönhatás. Lokális és delokalizált kötés. Három-központ kötvények. Orientációja és a telítettség kémiai kovalens kötés. VSEPR elmélet vegyérték héj és térszerkezete molekulák
Donor-akceptor kölcsönhatás - töltésátviteli között a donor és akceptor molekulák képződése nélkül közötti kémiai kötések őket (átváltási mechanizmus); vagy átadása a nem megosztott elektronpár a donor, hogy az akceptor, így a képződését kapcsolat (donor-akceptor mechanizmus).
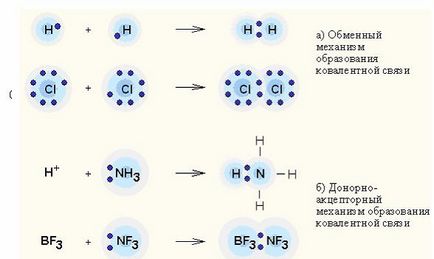
Kovalens kötés - a leggyakoribb formája a kémiai kötésre, amely miatt előfordul szocializációs elektronpár cseréje révén mechanizmus. amikor az egyes kölcsönható atomok szállít egy elektron, vagy egy donor-akceptor mechanizmus. ha a továbbított elektronpár a közös használatát egy atom (donor) egy másik atom (akceptor).
Delokalizált kötést - kötést elektronpár amely elterjedt több (több, mint 2) s yadr atomok (fémes kötés hasonlóság).
A kovalens kötés lehet lokalizálni és delokalizált. Úgynevezett lokalizált kötés, amely az elektronok hatékonyan megoszlik két mag kötési atom. Ha a kötő elektronok között oszlanak több mint két mag, az egyik beszél a delokalizált kötést.
Delokalizált kötést - jelentése kovalens kötés, molekulapályák amely több mint két atom.
Delokalizált kötések a legtöbb esetben π-kötés. Ezek jellemző konjugált rendszerek. Ezekben siste- max végzett speciális fajtája a kölcsönös egymásra hatás atomok - ragozás.
Konjugáció (mezo, a görög mesos -. Mean) - Az összehangolás kötéseket és díjak valós molekula (részecske) összehasonlítva egy ideális, de nem létező struktúrát.
Részvétel konjugációs delokalizált p pályák tartozhat két vagy π-linkek és több, vagy π-csatlakozás és egy atom p orbitális. Ennek megfelelően különbséget π, π-konjugáció és # 961 ;, π-konjugáció. konjugációs rendszer lehet zárt vagy nyitott, és tartalmazhat nemcsak szénatomok hanem heteroatomot.
Három-központ kételektronos kötést - az egyik lehetséges elektron-hiányos kötések. Azzal jellemezve, hogy a pár vegyérték elektronok lokalizált a térben közvetlenül három atom (innen a „elektron-hiányos” - „normális” esetben két-központ kételektronos kötést). Általános leírás a mechanizmus az elektron kötések adják szempontjából az elmélet molekulapályák (modell „a nem kötő” pályák).
A legnagyobb hozzájárulása a fejlesztés az elmélet trohtsentrovyh két-elektronos kötést végeztünk a tanulmány a bórhidridek és bór- a vegyületek, amelyekben az ilyen kötődést végre nagyon gyakran (pl, diborán).
Lehet, hogy más elektron deficiens kommunikációt egy másik aránya a vegyérték elektronok és a kötött atomok. Az ilyen kötődés gyakran hajtják végre a szerves fémvegyület.
VSEPR elmélet vegyérték pályák (OEPVO) - az egyik megközelítés szükséges kémiai megmagyarázni és megjósolni geometriimolekul. Ezen elmélet szerint, a molekula mindig formája, amelyben a külső elektronpár taszítás minimális (minimális energia elve).
Jellemző tulajdonságai a kovalens kötés - fókusz, telítettség, polaritás, polarizálhatóságának - meghatározzák a kémiai és fizikai tulajdonságai a vegyületek.
Orientációja kommunikáció miatt a molekuláris szerkezete az anyag és a geometriai forma a molekula. A szögek közötti két kötést úgynevezett vegyérték.
Telítettség - a képessége korlátozott számú atomokkal kovalens kötés. A kötések száma által alkotott egy atom, arra korlátozódik, hogy a külső atomi pályák.
A polaritás a kapcsolat miatt egyenetlen eloszlása az elektronsűrűség miatt a különbség a elektronegatív atom. Ezen az alapon a kovalens kötések felosztva apoláros és poláros (apoláros - kétatomos molekula áll, amelyek azonos atomokból (H2 Cl2 N2) és az elektron felhők minden egyes atom vannak elosztva képest szimmetrikusan ezen atomok .. Polar - kétatomos molekula atomokból áll különböző kémiai elemek, és a teljes elektron felhő felé mozog, az egyik az atomok, ezáltal egy aszimmetrikus eloszlása elektromos töltés a molekulában, generáló dipólmomentum a molekula).
A polarizálhatóságot kommunikációs kifejezett változó az elektronok hatása alatt egy külső elektromos mező, beleértve a más reaktív részecskék. A polarizálhatóságának elektron mobilitás meghatározzuk. Polaritását és polarizálhatóságának kovalens kötések meghatározza a molekulák reakcióképességének a poláros reagensek.
21. A kémiai kötés típusai és a kristályok. Típusai kristályrétegeiben. Alapjai a zenekar elmélet. Kommunikáció fémek, félvezetők és dielektrikumokra. A hibák a kristályrácsban. Szilárd oldatok. Az ionos kötés. Kölcsönhatása ionok a kristályrácsban. Az energia az ionos kristályrács, a hatás mértéke és ionos töltések
Sáv elmélet - a leírás a mozgás az elektronok kristályok, az alapja a modern elmélet fémek, félvezetők és dielektrikumok.
A nagysága a sáv rés a legfontosabb változó, és meghatározza az elektromos és optikai tulajdonságait az anyag.
Vezetékek - anyagok, amelyekből a vezetési sáv és a vegyértéke sávok átfedik egymást alkotnak egy zóna - a vezetési sáv (elektron így szabadon mozoghatnak közöttük).
Szigetelők - anyagokat, amelyekből a terület nem terjed ki. Annak érdekében, hogy át egy elektront vegyértékelektronját a vezetési sávban energia szint szükséges, így dielektromos alig vezetőképes.
Félvezetők - az anyagok, amelyek nem fedik egymást övezetben. Annak érdekében, hogy át egy elektront vegyértékelektronját a vezetési sávba, kevesebb energiát igényel, mint a dielektromos, olyan tiszta félvezetők gyenge áram halad.
Molekuláris · - a molekuláris rács a molekula, benne rejlik a rács vegyületet egy kovalens kötés. Itt nem tartalmazza fémek (a hidrogénatom kivételével, Si)? az összes szerves vegyületet H2SO4? HCI
· Atomic - a csomópontok atomok gyémánt, grafit - vízben nem oldódik tűzálló. nem oldható
· Ion - a csomópontok elrendezett pozitív és negatív ionokat, amelyek össze vannak kötve egymással elektromos vonzás só ionok. bázisként alkáli. Tartósság, a magas az olvadáspontja. Nem illékony. Sok vízoldható
· Fém - a csomópontok elrendezve fématomok, a hővezetési