korrózió terület
Ábra. 5. korrózió közötti érintkezés két fém
Hatása korrózióvédelem készítmény inhomogenitás képződéséhez vezethet mikrogalvanopar még a felületén az azonos fém. Ennek egyik példája a korrózió
fém a vízcsepp (ábra6). Mivel a felszíni víz rétegeket tartalmazhat több oldott oxigént, mint belső fém felülete a közepén egy csepp aktívabb (anód rész), és a kerületén a csepp lesz megfigyelhető csökkenését oxigén (katód rész). Szárítás után egy csepp elég mély rozsda folt jelenik meg a központban.
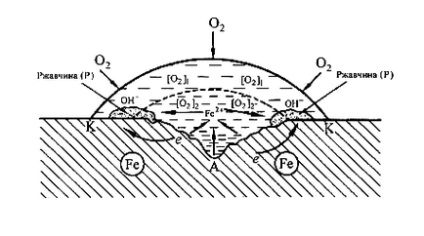
Ábra. 6. Vezetési vas korróziós alatt vízcsepp
Az ilyen galvanikus előfordulhat alatt gyakran a korrózió háztartási és ipari berendezések és a föld alatti szerkezetek, az egyenlőtlen aeratsiikislorodom egyes részei a fém felületén. Példaként szolgálhat a korrózió acél cölöpök hajtott be a folyó alsó (7. ábra).
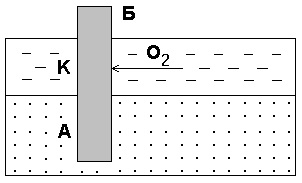
Ábra. 7. A korrózió ami egyenetlen oxigént. B - halom; A - anód része; K - katód részét
Része a halom, amely vízben, mossuk az oldott oxigén, és fog működni, mint egy katód. A talaj gyakorlatilag nincs
tartalmaz oldott oxigén és az a része a halom, amely
van akkor anodomi kitéve a pusztulásba.
Mechanikai feszültségek. Mikrogalvanopary mellett előfordulhat az intézkedés a belső és külső stressz (így például, hajlító és megereszkedett gerendák, intenzív hegesztések). Korrózió ebben az esetben vezet szemcsék közötti repedés vagy egy úgynevezett „kés” a korróziót. Ez a fajta korrózió miatt előfordul, hogy az a tény, hogy a feszített oldalán gerendák feszített interatomi kötvények és gyengébb, mint a felső oldalon. Gibbs energia ezen az oldalán a gerenda ΔG1. A tömörített oldalán tartó Gibbs energia negatív értéket ΔG2. Mivel dG társul potenciális AG = -nFE. akkor van egy pozitívabb potentsialE2 (katód) a tömörített oldalán. és nyújtja meg - potentsialE1 több negatív (anód).
Így a mechanikai feszültség mindig ad okot, hogy a galvanikus elektromotoros erő E1 = E2. Így a fém oldódását figyelhető meg kitágulás és összehúzódás, a régióban (a katód részek) kinyerjük oxidálószer (O2 vagy H +).
A kinetikai korróziós folyamatok. Számos példa van arra, hogyan aktívabb fémek oldódnak sokkal lassabban, mint a kevésbé aktív. Például, az arány az alumínium korróziós légköri körülmények között lényegesen kisebb, mint a korrózió sebességét vas (-0,44 V), bár a standardpotenciál alumínium több negatív (-1,66 V). Ez arra utal, hogy amellett, hogy a befolyása a termodinamikai tényező a korróziós folyamatokat is figyelembe kell venni, és kinetikai tényezők, beleértve a képességét, a fémek a legfontosabb lépés egy passzív állapot.
Fémek passziválás folyamat magában foglalja a kialakulását a felületen vékony filmek vízben oldódó vegyületek - oxidok, hidroxidok, sók vagy ezek keverékei. Ezek a blokkoló film felületén, és megakadályozzák elektron transzfer és az oxidálószer a fémfelülethez.
Ismeretes, hogy a fém korrózióját hidrogénnel depolarizációval
sokkal gyorsabban halad előre, mint a kisebb túlfeszültséget reakciót
a hidrogénfejlődés (N2, B) (lásd. táblázat. 3.).
Például, az E ° Pb2 + / Pb = - 0,126 V, azaz Ólom termodinamikailag nem stabilak savas közegben, de a híg kénsav és sósav fém nem reagált, így svintseN2 = -1,56 V.
Emiatt, a cink (E ° (Zn 2+ / Zn) = -0,76 V) is instabil savas környezetben. Azonban, mivel a magas hidrogén-túlfeszültség, ez nagyon lassan kiszorítja hidrogénatom savaktól.
Érintkezik a réz cink (Zn | H + | Cu), hidrogén-naCuvosstanovlenie végbe sokkal gyorsabb (N2 réz na0,4 Vmenshe mint Zn). Emiatt, a kapcsolatot a réz-cink oldódik nagyon aktív, ami kíséri intenzív hidrogénfejlődés réz.