A szerkezet a izomrost
Mozgásképesség - egyik jellegzetes tulajdonságai minden élőlény, a legegyszerűbb, hogy a legbonyolultabb. A csökkentés a különböző izmok és a mozgás a növények levelei, a dobogó csillók és csilló mozgás, a sejtosztódás és a mozgás a protoplazma - mindezek különböző formái a mozgási aktivitás a közös -prevraschenie kémiai felszabaduló energia az ATP hidrolízisével mechanikai. Ez az izom - a „gép”, amely konvertálja a kémiai energiát közvetlenül energiává Mechanikai munka (munka) és a hő. Szabályozója iokomotoraktivitást az izom a kalcium. Felderítése molekuláris mechanizmusainak villamosenergia-termelés, a kémiai átalakulás az ATP hidrolízis energiát mechanikai munkává, és a szabályozási mechanizmust ezen folyamatok a fő célja a biológiai mobilitás Biofizikai. A legnagyobb sikert elért ebben az irányban a tanulmány a legtöbb szervezett harántcsíkolt izmokat gerincesek.
Mielőtt rátérnénk a modern elképzelések a mechanizmus az izom-összehúzódás, meg kell vizsgálni a szervezeti felépítését főbb elemeit összehúzó -miofibrill és szarkomer.
A szerkezet az izomrostok.
Vázizmok alkotják többmagos kapcsolódó sejt ingerelhető plazmamembrán, amelyen keresztül jön az idegingerület, amely kiváltja az izom-összehúzódás. Az átmérője a szívizomsejt lényegesen rosszabb, mint a hossza. Túlsúlya hossza túlzott vastagság egy orsó ketrecben hívják lehetővé teszi szál (1. ábra). Azonban, meg kell jegyezni, hogy az izomrostok van kialakítva egyesítésével több egyedi sejtek. Ezért a miocén (nagyon nagy cella) tartalmaz több magot.
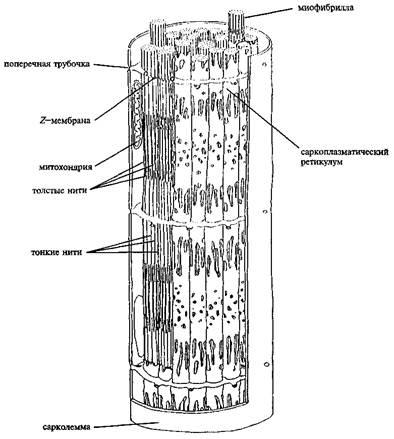
Belül a izomsejt (annak hosszanti keresztmetszete) van sorrendben 10 3 miofibrillumok. Izomsejteket áll több kontraktilis szálak - miofibrillumok elrendezve egymással párhuzamosan (1. ábra). Mifibrilly - képes csökkentési izzószál kötegek körülbelül 1 mikrométer átmérőjű. Válaszfalak úgynevezett Z-lemezek elválasztva miofibrillumok keresztirányban különböző egységekre a 2,5 mikron hosszúságú, amelyek úgynevezett szarkomer
Szarkomerben elemi egysége Szupramolekuláris összehúzó izomrostok. A elektronmikroszkópos felvételei hosszanti izomszövet részén látható, hogy szarkomerben áll párhuzamos sorok vastag és vékony fonalak (2a ábra). Z függőleges sötét vonalak megfelelnek a speciális szerkezeti fehérjék (dezmin) elválasztjuk a miofibrillumok szarkomer. Között látható vízszintes szál a kontraktilis berendezés. A Z-vonalak indulnak vékony szálakká, amelyek a elektronmikroszkópos felvételek megfelelnek a fény csíkok I. A központi része a sarcomer vastag filamentumok vannak elrendezve, amely megfelel a sötét sáv A. A közepén minden szalag egy további látható fény sávban N. A jelen két sötét részei sáv meghatározza az a tény, hogy ezekben a zónákban metszette vastag szálak vékony szálak. Világosabb csík (H terület) megfelel egy részét a sarcomer, ahol a sűrű szálak nem átfedésben vékony szálak. Anizotropikus lemezek (A) mutatnak kettős törést (lásd az előző téma.) Normál fényben sötétnek és polarizált - átlátszó (világos) a hosszanti és átlátszatlan (sötét) a keresztirányban. Isotropic lemezek (I) nem jellemző kettős törést.
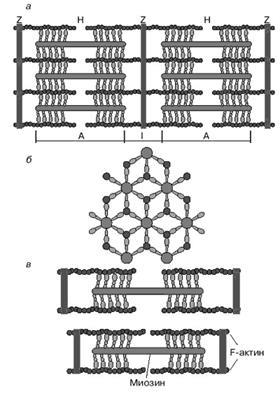
2. ábra: sematikus ábrázolása a szerkezet szarkomer izomrostok: egy - hosszmetszete, - egy keresztmetszeti nézete területén metszéspontjában vastag és vékony filamentumok - változása A hossz eredményeként mozgás a vastag és vékony filamentumok
Vastag szálak főként a miozin molekulák. Vékony filamentum fehérjék tartalmaznak három típusú aktin, tropomiozin és a troponin. Ha megvizsgáljuk egy keresztmetszetét sarcomerhossz a régióban, ahol a szomszédosak a vastag és vékony fonalak (sötét szalag része), akkor azt láthatjuk, hogy minden egyes vékony szál körül három vastag szálat, és az egyes vastag szál körül hat vékony szál (ábra. 2 b). Kölcsönhatása vastag és vékony filamentumok végzi úgynevezett cross-hidak kialakított fejek miozin molekulák (a 2., 3a, 3b). Ezek úgy vannak elhelyezve, tekintettel a hosszanti tengelye a miozin filamentum szöge 120 °. Kereszt-híd műveket, mint himiomehanichesky átalakító (azaz átalakítani ATP energiát mechanikai mozgás grebkovyh). Azáltal, hogy csökkenti az izom (ahogy mozog aktin és a miozin filamentumok egymáshoz képest) sarcomer csökkentheti annak hossza egyharmada (2c ábra).
A vastag filamentumok miozin kezdődött grebkovyh mozgása (miközben csökkenti) annak határokon hidak (3a ábra), a miozin fej kell kialakítaniuk az aktív hely a aktin filamentum. Az izom nyugodt ez vonatkozik ( „burkolt”) tropomiozin molekula (3b ábra). Tropomiozinnal molekula körül van tekerve a két aktin egy spirál, és fedezi az aktív helyek, amelyek érintkeznek miozinfejek történni az izom összehúzódását.
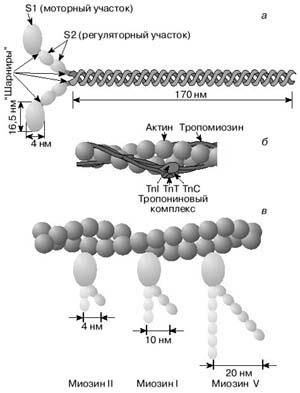
3. ábra A szerkezet a miozin molekula (a) és finom menettel (b). A relaxált izom tropomiozin fejét zavarja a kölcsönhatás a miozin és aktin (b). Bottom (c) ábra vázlatosan mutatja a különbséget a geometriai jellemzőinek motoros miozin molekulák részei három különböző típusú
Amellett, hogy az aktin, miozin és a tropomiozin, harántcsíkolt izom miociták tartalmaznak fontos szabályozó fehérje troponin, amely kapcsolatban van aktin és tropomiozinovoy menet (3b ábra). Az egyik alegységet alkotó troponin komplex képes kötődni Ca 2+ ionok. Amikor egy ilyen kölcsönhatás lép fel, troponin és tropomiozin hat a aktin filamentum felszabadítja az aktív helyen a miozin. Ezzel elkerülhető zavaró kölcsönhatás (ábra 3c). Ezután jön közvetlenül hatnak az izom-összehúzódás.