Formula foszfor-oxid Chemistry
Definíció és foszfor-oxid formula
foszfor-oxid (foszforsav-anhidrid) (foszfor van egy vegyértéke (V) és a oxidációs állapota +5) normál körülmények között egy fehér, nagyon higroszkópos (erős vízelvonó szer) kristályok (ábra. 1).
Létezik amorf (pehely), és stekloobraznomsostoyanii. Amikor fűtött, kristályos oxid foszfor (V) szublimál. Olvadékok csak nyomás alatt, akkor átmegy a híg folyadékból.

Ábra. 1. foszfor-oxid (V). Megjelenés.
A további melegítés polimerizálódik, üveges termék képződik hűtés hatására folyadékot. Olvadáspont 422 ° C, forráspontja 591 ° C-on
Mutat savas tulajdonságai és vízzel heves reakcióba lép és lúgok.
A kémiai képlet a foszfor-oxid-
A kémiai képlet a foszfor-oxid (V) P2 O5. Ez azt mutatja, hogy a szerkezet az e molekula két foszfor-atomot (Ar = 31 amu) és öt oxigénatom lehet (Ar = 16 amu). Szerint a kémiai képlet számított molekulatömege foszfor-oxid (V):
Úr (P2 O5) = 2 × 31 × 5 + 16 = 62 + 80 = 142.
Grafikus (szerkezeti) általános képletű foszfor-oxid
Structure (grafikus) foszfor-oxid (V) képletű sokkal jobban használható. Ez azt mutatja, hogy az atomok vannak csatlakoztatva egymáshoz a molekulán belül (ábra. 2). foszfor-oxid (V) dimerizálni (megfelel a kémiai képlete P4 O10), és annak létezését formában a legelőnyösebb.
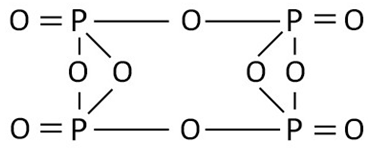
Ábra. 2. Grafikus képletű foszfor-oxid (V).
Példák problémák megoldása
Égése közben 2,3 g, a szerves anyag szénből, hidrogénből és oxigénből, alakított 4,4 g szén-dioxid és 2,7 g víz. Sűrűség ágens gőz oxigén egyenlő 1,44 g Határozza molekuláris képlete az anyag.
Szénhidrogén moláris tömege lehet meghatározni a sűrűsége tekintetében oxigén:
Msubstance = 32 × 1,44 = 46 g / mol.
Tömeg szén-dioxid és víz találunk a szén tömege és a hidrogén, és oxigén (a különbség a anyag tömege és a szén- és hidrogénatomok az ott). Ahhoz azonban, hogy kezd számítani a moláris tömegeket. Mint ismeretes, a moláris tömege a molekula az összege a relatív atomi tömegek a tartalmaznak a molekulában (M = úr):
M (CO2) = Ar (C) + 2 × Ar (O) = 12+ 2 × 16 = 12 + 32 = 44 g / mol;
M (H2O) = 2 × Ar (H) + Ar (O) = 2 × 1 + 16 = 2 + 16 = 18 g / mol.
m (C) = 4,4 × 12/44 = 1,2 g
m (H) = 2,7 × 2 × 1/18 = 0,3 g
m (O) = msubstance - m (C) - m (H) = 2,3 - 1,2 - 0,3 = 0,8 g
Jelöljük a mólszáma tartozó elemek a csatlakozások az „x” (szén) „y” (hidrogén) és «Z» (oxigén). Ezután a mólarány a következő lesz:
x: y: z = m (C) / Ar (C). m (H) / Ar (H). m (O) / Ar (O);
x: y: z = 1,2 / 12. 0,3 / 1 0,8 / 16;
x: y: z = 0,1. 0,3: 0,05 = 2. 6. 1.
Ezért a legegyszerűbb képlet a szerves vegyület formájában C2 H6 Oand móltömege 46 g / mol [M (C2 H6 O) = 2 × Ar (C) + 6 × Ar (H) + Ar (O) = 2 × 12 + 6 × 1 + 16 = 24 + 6 + 16 = 46 g / mol].
Ahhoz, hogy megtalálja a valódi képletű megtalálják az arány a szerves vegyület kapott móltömeg:
Ez azt jelenti, egy szerves vegyület, a képlet formájában fog a C2 H6 O.