Energia RCOOH b «RCOO bh reakciókoordináta energia és
1. sóinak kialakítása
Szerves savak, hogy sót képez fémekkel, azok oxidjait, karbonátjait, hidrogén-karbonátok és az alkálifém, például a:
CH3COOH + NaOH ® CH3COONa + H2O
2. Az oktatás-halogenidek
Az intézkedés alapján a sav-halogenidek, karbonsav anhidridek, foszfor formájában (hidroxil-szubsztituált halogénatommal):
CH3COOH + PCI5 ® CH3COCl + POCI 3 + HCl
A savkloridok is előállíthatók a tionil-klorid a karbonsav:
CH3COOH + SOCI2 ® CH3COCl + SO2 + HCI
Karbonsavakat visszaállítása csak segítségével egy nagyon erős redukáló szerekkel, azonban primer alkoholokat (helyett aldehidek) mindig kialakítva reakciótermékek:
CH3COOH + LiAIH4 ® CH3CH2OH
Karbonsavak nagyon könnyen elveszti a szén-dioxid. Jellemzően a szénhidrogén-képződik. Az alifás karbonsavat dekarboxilezzük a különböző katalizátorok jelenlétében réztartalmú. CH3CH2COOH ® CH3CH3 + CO2.
Arra utal, hogy a reakció a dekarboxilezést és a Kolbe-szintézis (lásd. Lecture №2).
Jelenlétében egy erős sav (például kénsav) ad-karbonsav-észterek és alkoholok:
CH3COOH + CH3CH2OH «CH3COOCH2CH3 + H2O
A reakció eredményeként egy egyensúlyi keveréke. Eltolásához az egyensúly irányába termék képződését, nagy feleslegben alkoholt vagy vizet eltávolítjuk úgy van kialakítva.
Az észterezést mechanizmus egy addíciós reakció - hasítás (acil nukleofil szubsztitúció) Proton-katalizátort, amely megkönnyíti a támadás a karbonil-csoportot egy nukleofil:
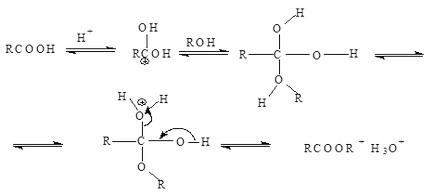
Hangyasav. Előállítva nátriumsója (formiát) által képzett halad szénmonoxid keresztül 25-30% lúgos oldat:
NaOH + CO ® HCOONa
A szuszpenziót nátrium-formiát, majd a bomlás hangyasavat.
Hangyasavat használunk katalizátorok előállítására, a gyógyászatban és bizonyos szintézisek során. az N, N-dimetil-formamidban, HCON (CH3) 2, a legnagyobb értéket a származékai. Ez a vegyület szelektív oldószerben a kiosztási acetilén gáz-keverékek és abszorpciós HCl, SO2, CO2 és egyéb gázok.
Hangyasav számos kémiai tulajdonságai savak, de benne rejlő és az egyes egyedi jellemzői:
1. egy jó redukálószer (könnyen oxidálódik):
HCOOH + HgCl2 ® Hg + CO2 + 2 HCI
Hangyasav redukáló tulajdonságai annak a ténynek köszönhető, hogy az időben egy sav hidroxialdehidekre és ez nyilvánvaló a képlet.
2. melegítés hatására tömény H2SO4 bomlik, amely során víz és a CO:
3. alkálifémsók elbomlanak, amikor kondenzálva az oxalátsót (oxalát):
2 HCOONa ® H2 + NaOOC-COONa
Ecetsav. Széles körben használják az észterek előállításához, ecetsav-anhidrid, vinil-acetát, és a termelés festékek, gyógyszerek és szagos anyagok. Nagy gyakorlati jelentősége van az ecetsav sói - a nátrium, alumínium, króm, vas, réz, ólom, stb Az iparban ecetsavat állítjuk elő számos módon .:
1. oxidációja alkánok;
2. Az oxidációt etanol;
3. acetilén hidratálás és oxidációja a kapott acetaldehid;
4. ecetsav fermentációs cukor-tartalmú oldatokkal.