Boyle-törvény, Chemistry for Dummies nulla kémia alapjai
A 25. lecke, „Boyle-törvény” természetesen „Chemistry for Dummies” úgy a törvény összekötő nyomás és gáz térfogat, valamint grafikonok nyomás függvényében körének és mennyiségének a nyomást. Emlékszem, hogy az utolsó óra „gáznyomás” áttekintettük a készülék és működtetése higany barométer, és megadta a meghatározása nyomás, és felülvizsgálta egység.

Robert Boyle (1627-1691), akinek köszönhetjük az első lényegében helyes meghatározás a kémiai elem (tanulnak fejezet. 6), én is érdekelt a jelenségeket, amelyek előfordulnak a véredények semmiből. Feltalálás vákuumszivattyú szivattyúzására levegőt lezárt edényben, ő hívta fel a figyelmet, hogy az ingatlan, ismerős, aki történetesen a hólyag futball-labda, vagy finoman nyomja a léggömb: a több sűrített levegő egy zárt edényben, annál inkább ellenáll tömörítés. Boyle úgynevezett ingatlan „rugalmassága” a levegő és a mért ez egy egyszerű ábrán bemutatott berendezést. 3.2 a és b.

Boyle zárva higany kevés levegő a zárt vége a hajlított (ábra. 3-2 is), majd benyomja a levegő, fokozatosan hozzáadjuk a higany a nyitott vége a cső (ábra. 3-2 B). Nyomás által elszenvedett levegő a zárt része a cső összegével egyenlő a légköri nyomás és a nyomás higanyoszlop magassága h (h - a magasságot, ameddig a szint higany a nyitott vége a cső meghaladja azt a szintet higany a zárt vége). Boyle kapott nyomás mérése és mennyiségi adatok táblázatban mutatjuk be. 3-1. Bár Boyle nem különleges intézkedéseket kell fenntartani az állandó hőmérsékletet a gáz, úgy tűnik, az ő kísérletei, hogy csak csekély mértékben változott. Mindazonáltal Boyle észrevette, hogy a hőt a gyertya lángja okozott jelentős változást a tulajdonságait levegő.
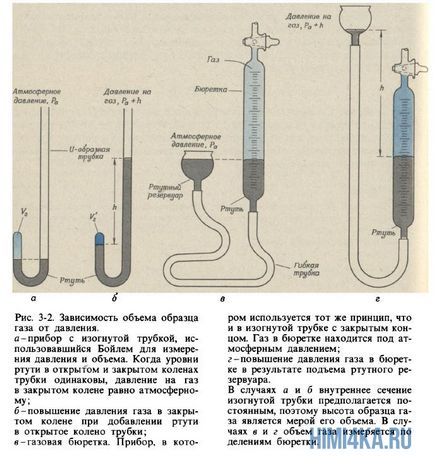
Elemzés a nyomás és a levegő térfogata során tömörítési
3-1. amely Boyle kísérleti adatokat a kapcsolatot a nyomás és térfogat a környezeti levegő alatt van elhelyezve egy légterelő.


Miután a kutató kap adatokat, mint például azok, az a táblázatban látható. 3-1, megpróbálja megtalálni egy matematikai egyenlet. kapcsolja össze két, egymástól független értékek, amit mérni. Az egyik módja annak, hogy kapjunk egy ilyen egyenlet grafikont különböző mértékben értékétől függően az egyik a másik a reményben, hogy egy egyenes vonalú grafikon. Az általános egyenlete egyenes vonal a formában:
ahol x és y - a változók egymással összefüggenek, és a és b - állandók. Ha b értéke nulla, az egyenes vonal áthalad a származási.
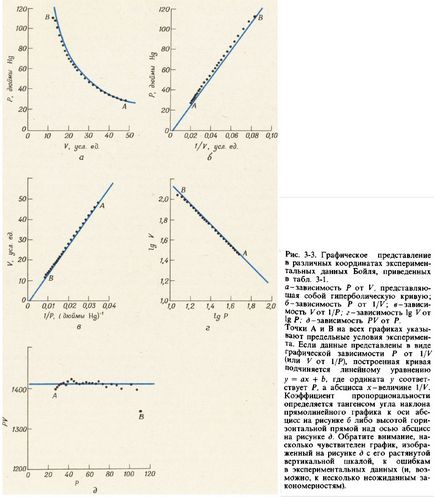
Ábra. 3-3 mutatják különböző módszerek grafikus bemutatása az adatok a P nyomás és a térfogat V, táblázatban. 3-1. A grafikonok a P 1 / K és attól függően, V 1 / R egyenes vonalak az origón áthaladó. A telek a logaritmusa logaritmusa P és V jelentése egy egyenes vonal negatív meredekséggel, a szög tangense amely egyenlő - 1. Ezek a diagramok vezetnek egyenértékű egyenletek:
Mindegyik egyenletek egyik megvalósítási Boyle törvényének. amely általában az alábbiak szerint történik: egy adott móljainak száma a gáz nyomása arányos annak térfogatával, feltéve, hogy a gáz hőmérséklete állandó marad.
By the way, akkor valószínűleg nem értette, miért Boyle törvény az úgynevezett kettős nevet. Ez történt így, mert a törvény függetlenül Robert Boyle, aki felfedezte, hogy 1662-ben fedezték fel Edmom Mariott 1676. Ez így volt.
Amikor a kapcsolat a két mért érték egyszerűen olyan mértékben, ebben az esetben, akkor lehet telepíteni és numerikus módszerrel. Ha minden egyes értékére a P nyomás szorozva a megfelelő mennyiség értékét V, ez nem nehéz biztosítani, hogy az összes termék a gáz egy adott mintát állandó hőmérsékleten megközelítőleg azonos (lásd. Táblázat. 3-1). Így felírhatjuk
Egyenlet (B-Sr) leírja hiperbolikus függését értékei közötti P és V (lásd. Ábra. 3-3 is). Annak ellenőrzésére, hogy a P termék · V grafikon épített a kísérleti adatokból a függését P V ténylegesen megfelel hiperbola konstrukció több további ütemezés függvényében P és ellenőrizze, hogy ez egy egyenes vízszintes vonal (lásd. Ábra. 3-3, d) .
Boyle megállapította, hogy bármely adott mennyiségű gáz állandó hőmérsékleten kapcsolat a P nyomás és a V térfogat lennie
kielégítően által leírt kapcsolatban
- P · V = const (állandó T, és n) (3-4)
A képlet a Boyle-törvény
Összehasonlításképpen, a térfogat és a nyomás az azonos gázminta eltérő körülmények között (de állandó hőmérsékletű) célszerűen képviselik Boyle-törvény a következő képlet:
ahol az indexek az 1. és 2. megfelelnek az két különböző körülmények között.
4. példa szállítják a Colorado Plateau műanyag zacskók élelmiszer-ipari termékek (lásd. 3. példa) gyakran tört, mert a levegő ott csapdába ejtett, emelés közben a tenger szintje a tengerszint feletti magasság 2500 m körülményei között alacsony légköri nyomáson, kitágul. Ha azt feltételezzük, hogy a táska belsejében atmoszférikus nyomásnak megfelelő tengerszint felett, arra a következtetésre jutottak, 100 cm3 levegő, milyen hangerővel kell vennie ezt a levegőt ezen a hőmérsékleten a Colorado-fennsík? (Tegyük fel, hogy a termékeket nyújtásához használt összezsugorodott táskák korlátozása nélkül bővítése a levegő, a hiányzó adatokat kell venni a 3. példában)
döntés
Mi használjuk a Boyle-törvény formájában egyenlet (3-5), ahol az index 1 fog utalni a feltételeket a tengerszinten, és az index 2 - feltételekkel magasságban 2500 m tengerszint feletti magasságban. Ezután P1 = 1.000 atm, V1 = 100 cm 3 P2 = 0,750 atm és V2 kiszámítását. Így