Ilyen megoldásokat problémák 1
Probléma 1. Számítsuk ki a hidrogénionok koncentrációját a HCN oldatban (lásd a = 10 -3 M), ha = 4,2 ∙ 10 -3.
Megoldás: disszociációs hidrociánsav bevételt a következő egyenlet szerint HCN ↔ H + + CN -; ionok koncentrációja [H +] és [CN -] az oldatban egyenlő egymással (például N SN- + = 1: 1, ahol az.
- sztöchiometrikus együtthatók), azaz [H +] = [CN -] = Lásd. mol / l; Ezután a [H +] = [CN -] = 4,2 ∙ 10 -3 ∙ 10 -3 = 4,210 -7 mol / l.
Probléma 2. Számítsuk ki a hidrogénionok koncentrációját és a hidroxid-ionok rstvore NH4OH, Lásd koncentráció = 0,01 m, ha Kd = 1,810 -5.
Megoldás: ammónium-hidroxid disszociál a következőképpen:
NH4OH ↔ NH4 + + OH -. disszociációs állandó a formája
koncentráció ammóniumion [NH4 +] és a hidroxid [OH -] egybeesnek ( (NH4 +): (OH -) = 1: 1), hogy kijelölje őket x:
[NH4 +] = [OH -] = x mol / l. akkor a kifejezés a Cd válik
1,810 -5 = x2 / 0,01-x. Feltételezve, hogy x <<См. решаем уравнение
1,810 -5 = x 2 / 0,01 x. X =
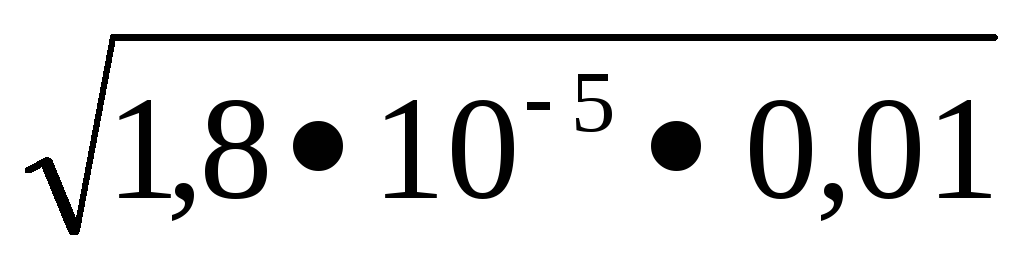
A koncentrációban hidrogén-ionok és a hidroxid keresztül kapcsolódó ionos terméket vízzel KW = [H +] [OH -] = 10 -14. kifejezni a hidrogénion-koncentráció [H +] = kW / [OH -] és kiszámítja annak értéke:
[H +] = 110 -14 / 4,210 -4 = 2,310 -11 mol / l.
Probléma 3. Határozza meg az oldat pH-HCl ( = 1), ha CM = 2 ∙ 10 -3 M
Megoldás: disszociációja HCI végbe a következő egyenlet szerint
HCI H + + Cl -. A hidrogénion-koncentráció [H +] = Lásd = 1 2 ∙ ∙ 10 -3 = 2 ∙ 10 -3 mol / l. A pH = - lg [H +] = - LG2 ∙ 10 -3 = 2,7.
Feladat 4. Határozzuk meg a moláris koncentrációja ammónium-hidroxid, ha a pH = 11, és Kd = 1,8 ∙ 10 -5.
Megoldás: hidrogén-ion-koncentráció [H +] = 10 - pH = 10 -11 mól / l. A ion terméket víz koncentrációját határozzuk meg [OH -] = Kw / [H +] = 10 -14/10 -11 = 10 -3 mol / l. Ammónium-hidroxid - gyenge bázis, és jellemzi az egyenlet a disszociációs reakció
NH4OH ↔ NH4 + + OH -. Az expressziós a disszociációs állandó
a termék oldhatóságát
Anyagok, jellegétől függően, eltérő vízoldhatósága, ami mozog frakciók több száz milligramm gramm literenként. Mérsékelten oldódik elektrolitok képeznek telített oldatok igen kis koncentrációk, így feltételezhető, hogy a disszociációs mértéke eléri az egységet. Így, telített oldható elektrolit oldat egy olyan rendszer, amely egy megfelelő megoldást, az egyensúly a csapadékot az oldott anyag. Állandó környezeti feltételeket az oldódási sebesség egyenlő kicsapódni kristályosítási folyamat sebessége: Kn Am K ↔ n + m + m A - n (1)
Ahhoz, hogy ezt a folyamatot használ heterogén egyensúlyi egyensúlyi állandó nevezett oldhatósági terméket PR = [K + m] n [A - n] m. ahol a [K + m] és [-N] - ion koncentráció a telített oldat (mol / l). Például:
AgCl = Ag + + Cl -. PR = [Ag +] [Cl -]; Itt n = m = 1.
PbI2 = Pb 2+ + 2I -. PR = [Pb 2+] [I -] 2; Itt n = 1, m = 2.
WP jellegétől függ az oldott anyag és a hőmérsékletet. PR a táblázatos érték. Ismerve PR, lehet koncentrációjának kiszámításához telített anyag oldatát, és hogy értékelje annak oldhatósága g per 100 ml víz (velichinas. Redukálható Referenciák) és meghatározza azokat a lehetséges elvesztése anyag a csapadékot.
Az (1) egyenlet kapcsolat telített oldatot rastovrimogo kemény anyag (. Lásd mol / l) a PR értéke határozza meg a következő egyenlet:

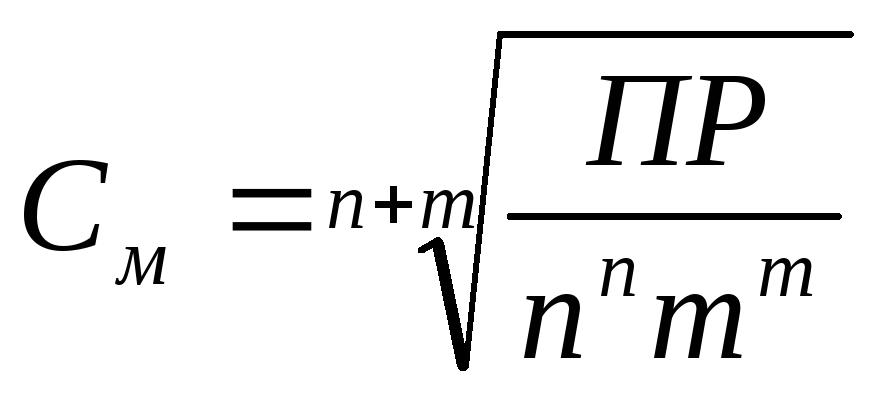
ahol n és m -stehiometrichekie együtthatók Eq. 1.
Probléma 5. telített oldat Koncentráció (Lásd) Mg (OH) 2 jelentése 1,1 • 10 4 mol / l. Írjon egy kifejezést a PR és számítja ki az értéket.
Megoldás: A telített rastvoreMg (OH) 2 egyensúly jön létre a csapadékot és rastvoromMg (OH) 2 ↔Mg 2+ + 2 OH -. Régiók, amelyekben a kifejezés PR = [Mg 2+] [OH -] 2. Ismerve a koncentrációja ionok, lehetőség van, hogy megtalálják a számértéket. Mivel a teljes disszociáció
Mg (OH) 2, annak telített oldat koncentrációja Lásd = [Mg 2+] = 1,110 -4 mol / l, és a [OH -] = 2 [Mg 2+] = 2,210 -4 mol / l. Ezért, PR = [Mg 2+] [OH -] 2 = 1.1. 10 -4 (2,2 10 -4) 2 = 5,3. 10 -12.
Feladat 6. koncentrációjának kiszámításához a telített oldat, és a PR ezüst-kromát, ha 0,5 liter vízben oldható só 0,011 g.
Megoldás: Annak megállapításához, a moláris koncentrációja telített rastvoraAg2 CrO4 használni formuloyCM =
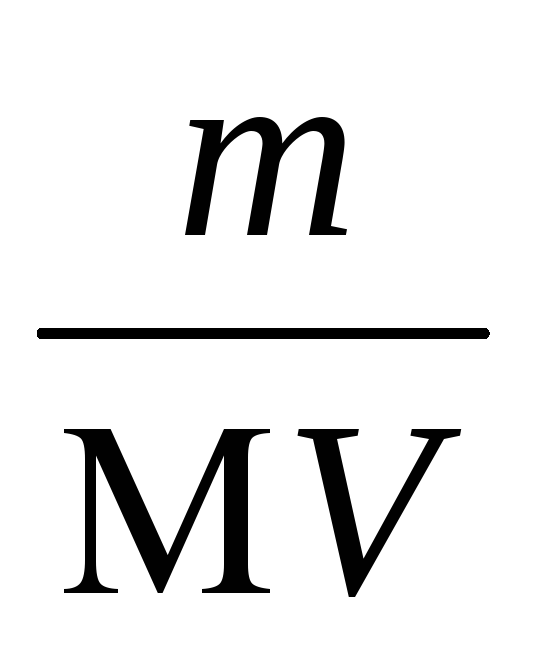
Így CR = (1,89610 -4) 2 (9,4810 -5) = 3,410 -12.
Feladat 7. elkészítheti CaCO3 sóoldatok koncentrációjú CaCO3 C1 = 10 -2 M és C2 = 10 -6 M. Ha PRSaSO3 = 3,810 -9.
Megoldás: Ismerve az érték a PR, ki tudjuk számítani az összefonódás
telített sóoldat és összehasonlítva a javasolt
koncentrációk, következtetést levonni a lehetőségét, vagy lehetetlensége oldatok előállítása. Oldódása kalcium-karbonát átáramlik az áramkör CaCO3 ↔Ca 2+ + CO3 2- Ebben uravneniin = m = 1, akkor
C1> Lásd - oldat előkészítéséhez lehetetlen, mivel a kicsapása;
C2 <См – раствор приготовить можно.
ioncserélő reakciót
A elektrolit oldatok, azzal jellemezve, egy ioncserélő reakciót. Előfeltétele az ilyen reakciók áramlási majdnem a végén, hogy távolítsa el az oldatból különböző ionok miatt:
1) csapadékot képezünk
FeSO4 + 2 NaOH Fe (OH) 2 + Na 2SO 4 - molekuláris egyenlet (MU)
Fe 2+ + SO4 2+ 2Na + + 2OH - Fe (OH) 2 + 2Na + + SO4 2 - ionos egyenlet (IMD).
Fe 2+ + 2OH - Fe (OH) 2 (OL Fe (OH) 2 = 4,810 -16) - rövid ionos egyenlet csapadék képződése céljából;
2) elválasztjuk a gáz
kialakulását illékony vegyületek.
3) kialakulását gyenge elektrolitok
a) egyszerű dolog:
2K + + 2CN - + 2H + + SO4 2- 2HCN + 2K + + SO4 2- (IMD)
CN - + H + HCN (KdHCN = 7,8 • 10 -10) -ion-molekuláris-ur e elektrolitaHCN gyenge képződése.
b) komplex vegyületek:
Zn 2+ + 4NH3 [Zn (NH 3) 4] 2+ - egy rövid-ionos egyenlet kation komplex képződését.
Vannak olyan folyamatok, amelyek gyenge elektrolitok vagy gyengén oldódó vegyületek között a kiindulási anyagoktól és a reakció termékek. Az egyensúlyi ebben az esetben felé tolódik az anyagok kialakulását, amelyek a legalacsonyabb disszociációs állandó vagy keletkezése irányába kevésbé oldódó anyagok:
Az egyensúlyi irányába van eltolva, a formáció a vízmolekulák.
B) AgCl + NaI AgI + NaCl (MU)
AgCl + Na + + I - AgI + Na + + Cl -
AgCl + I - AgI + Cl - (IMD)
Egyensúlyi felé van tolva a kialakulását AgJ csapadék.
B) eljárások előfordulhat az egyenletek és ahol gyengén oldódó vegyület, és egy gyenge elektrolit
MnS + 2H + + 2Cl - Mn 2+ + 2CI - + H2S
MnS + 2 H + Mn 2+ + H2 S (IMD)
PRMnS = 2,510 -10; [S-2] =
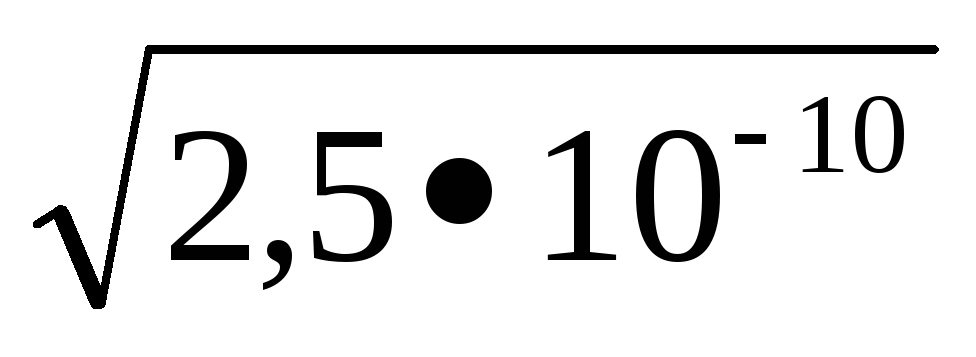
KdH2S = K1 K2 = 610 -22; [S 2-] =
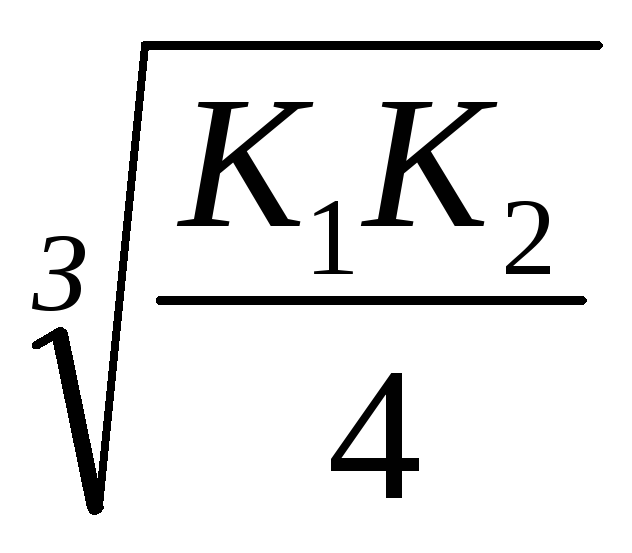
Kapcsolása S 2- ionok molekulyH2 Sproiskhodit teljesebb, mint vMnS, így a reakció az előre irányban felé obrazovaniyaH2 S
Hidrolízis az eredménye közötti kölcsönhatás a polarizáció só ionok azok hidratációs héj. Hidrolízis - egy kicserélődési reakcióban a molekulák közötti az oldatban a víz és a só ionok. Ennek eredményeként a hidrolízis, képződése miatt Valamely gyenge elektrolit (gyenge sav vagy gyenge bázis), az ion egyensúlyi megváltozik O⇄N + H2 + OH - miatt a kötődése H + vagy OH - és a közeg pH-ja változik. Hidrolízis alávetni-sók, amelyek egy gyenge sav vagy gyenge bázis ion. Képzett sók ionjait erős savakkal és erős bázisokkal, nem hidrolizál (NaCl, Na 2SO 4). A hidrolízis termékei lehetnek gyenge elektrolitok malodissotsiiruyuschie, és nehezen illó anyag. Hidrolízis - fázisos válasz esetén többszörös töltésű ion a lépések száma megegyezik annak ellenében. Hidrolizál pokationu sók anionjai egy erős sav és a gyenge bázis kationok. Például, a gyenge bázisok gidroksidyp - fémek és d (Kd 10 -4), és ammónium-hidroxid.
Cink-klorid - só képződött gyenge bázis Zn (OH) 2 és az erős sósavoldattal. cink kation a töltés 2+, ezért a hidrolízis kerül sor két szakaszból áll:
Zn 2+ + HOH ↔ ZnOH + + H + lépek
ZnOH + + HOH↔ Zn (OH) 2 + H + IIstupen
Ennek eredményeként ez a kölcsönhatás lép feleslegben H + ionok ([H +] [OH -]). oldatot megsavanyítjuk (pH =<7).
A hidrolízist a anion. Az ilyen típusú hidrolízis jellemző a sók anionjai a gyenge savak (Kd 10 -3) és egy erős bázis kationok (KD> 10 -3). Tekintsük hidrolízis kálium-karbonát - képzett só gyenge szénsav kislotoyH2 CO3 (. I = 4,5 KD 10 -7) és erős osnovaniemKOH, karboxi anion, amelynek töltése (2). A hidrolízis zajlik két szakaszból áll:
Ebben az esetben, a felszabaduló ionok OH - ([H +] [OH -]) - Az oldatot meglúgosítjuk (pH> 7).
Irreverzibilis hidrolízis. Alkotott sók egy gyenge bázis, és a gyenge savas hidrolízisével kationok és anionok. Az eredmény a hidrolízis függ Kd-értékek a bázis és a sav. Tekintsük hidrolízis-ammónium-fluorid - képzett só gyenge
bázis NH4OH (Kd = 1,8 10 -5.), és a gyenge sav HF (6,8 Kd = 10 -4.):