Kén (lat Kén.) - nonmetal elem. A kémiai S szimbólum, a sorozatszámot a periódusos - 16 Valence kén állítottuk még mielőtt tanulmányozza a szerkezete az atom. Értékét alapján határozzák meg tulajdonságait helyettesítő, vonzzák vagy csatolni egy sor más atomok vagy csoportok. Később, a kutatók azt találták a szerepét negatívan töltött részecskéket (elektronok) esetén egy kémiai kötés.
Valence kén: amelyek különösen atomok befolyásolja az értékét?
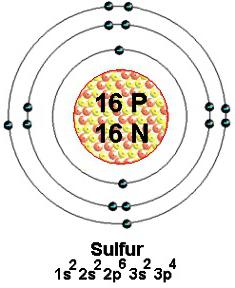
A leggyakoribb kémiai elem a Földön a 16. helyen. Ez akkor fordul elő formájában fényes sárga kristályok vagy por a kőzetekben közelében aktív és inaktív vulkánok. A legismertebb természetes vegyületek - szulfidok és szulfátok.
Jellemzői elemek és anyagok:
- Erős nonmetal.
- By elektronegativitási (EO), vagy képesek vonzani elektronok kén hozamok csak fluort, oxigén-, nitrogén-, klór- és brómatom.
- Ez reagál fémek és nemfémek, egyszerű és komplex vegyületek.
A különbségek a tulajdonságok függnek a szerkezet és az állami az atom, a különbség a értékei EO. Lássuk, mit lehet egy vegyértékű kén-vegyületek. Azok kémiai viselkedése függ a hatalmi struktúra borítékok, száma és elrendezése a külső elektronok az atom.
Miért vegyérték más?
Stabil izotópok természetes kén tömegszáma 32 (leggyakoribb), 33., 34. és 36. Mindegyik atom nuklidok 16 tartalmaz pozitív töltésű protonok. A tér közelében, a nucleus mozognak hatalmas sebességgel 16 elektronokat. Ezek végtelenül kicsi, negatív töltésű. Kevésbé vonzódik a sejtmagba (lazább) 6 külső részecskék. Több vagy mindegyikük részt vesz a kialakulását különböző kémiai kötés. Szerint a modern koncepciók vegyértékével kén száma határozza meg a létrehozott közös (ragasztás) elektron pár. Általában ábrákat külső részecskék vesznek részt a folyamatban, amelyet egy pont körül vegyjele.
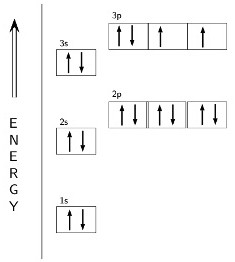
Mivel egy vegyértéke szerkezetétől függ az atom?
A szerkezet tudja mutatni szintek és sublevels (s, p, d) az energiát diagramot, amelyből a vegyértéke kén függ képlet. Két, egymással ellentétes irányú nyilak szimbolizálják párosított, egy - párosítatlan elektront. A külső tér kénatom pályák részecskék formájában a 6. és a 8. szükséges a stabilitás a oktett szabályt. Valence Shell konfigurációs tükrözi képletű 3s23p4. Az elektronok befejezetlen réteg van egy nagy tartalék energiával, ami az instabil állapotban az atom. Annak érdekében, hogy a stabilitás a kénatom igényel két további két negatív részecskék. Ezek során kaphatjuk a kovalens kötések képződését más elemekkel vagy miatt a felszívódása két szabad elektronokat. Ebben az esetben, a kén egy vegyérték II (-). Az azonos értékű lehet beszerezni a következő képlet segítségével: 8 - 2 = 6, ahol 6 - a csoport száma, amelyben az elem.
Ahol vannak olyan vegyületek, amelyekben az vegyértéke kén II (-)?
Element vonz vagy teljesen veszi elektronokat atomok alacsonyabb elektronegativitási értéke szerinti Pauling skálán. Valcncy II (-) látható a szulfidok a fémek és nemfémek. Egy kiterjedt csoportja az ilyen vegyületek találhatók a készítményben a kőzetek és ásványi anyagok nagy gyakorlati jelentőségű. Ezek közé tartozik a pirit (FeS), szfalerit (ZnS), galenit (PBS), és más anyagok. vas-szulfid kristályok szép sárgásbarna színű és a csillogás. „Bolondok aranya” ásványi pirit gyakran nevezik. A fémek a saját ércek végzett kalcinálás vagy csökkentése. A hidrogén-szulfid H2S azonos elektronikus szerkezetek, mint például a víz. Az eredete H2S:
- szabadul során a bomlási fehérjék (például csirke tojás);
- Úgy tör vulkáni gázok;
- Felhalmozódik természetes vizekben, olaj;
- megjelent a üregek a földkéregben.
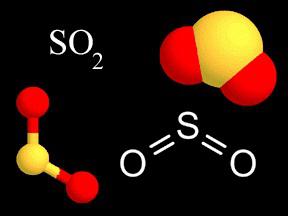
Miért van a képlet valens kén-oxid-SO2?
Formula-dioxid azt jelzi, hogy egy kénatomot a molekulában kötve két oxigénatomot, amelyek mindegyike kell lennie 2 az elektron oktett. A kapott kötés a természet szerint poláris kovalens (EO több oxigént). A vegyérték a kén ezen vegyületnek a értéke IV (+), mert a kénatom elektron 4 kiszorítjuk felé a két oxigénatomot. A képlet írható fel: S2O4, de a szabályok szerint kell csökkenteni 2. dioxidot vízben oldva formákban kénessav ionok gyengék. A sók - szulfitok - erős redukáló szerekkel. SO2 gáz egy köztitermék előállítására kénsav.
Mely anyagok kén mutat legnagyobb vegyértékű?
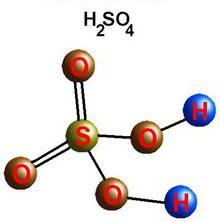
Oxid vagy SO3 S2O6 - színtelen folyadék alatti hőmérsékleten 17 ° C-on, megkeményedik. A vegyület SO3 vegyértéke oxigén II (-), és a VI (+) kén. Magasabb-oxid feloldódik a vízben, és alkot egy erős kétbázisú kénsavat. Egy nagy szerepe van a gyártási folyamat egy anyag „a kenyér, a vegyipar.” Fontos szerepet játszik a gazdaság és az orvostudomány tartozik savas sók - szulfátok. Használata hidratált kalcium (gipsz), a nátrium-(Glauber-só), a magnézium (angol vagy keserű só).
A formáció különböző típusú kémiai kötés részt vehet 1, 2, 3, 4, 6, a külső elektronok. Felhívjuk a vegyérték-kén, tekintettel arra, hogy vannak ritka és instabil vegyület: I (-), II (-), II (+), III (+), IV (+), VI (+). Egy második pozitív vegyértékei elem szerez monoxid SO. A leggyakoribb értéke II (-), IV (+), VI (+) azt mutatja, kén összetételében anyagcsoport rendelkező ipari, mezőgazdasági és orvosi jelentősége. Vegyületei gyártásához használt tűzijáték.
A nagy probléma a rögzítés hulladék gázok, beleértve az ártalmas az emberekre és a környezetre IV kén-oxidok (+), VI (+) és a hidrogén-szulfidot. Bevált technológia feldolgozására ezen hulladék gázok és megszerzése őket a kénsav-szulfátok. Ebből a célból, a vegyi üzemekben állítottak közelében acélművek vagy ugyanazon a területen. Ennek eredményeként, a szennyezés mennyiségének csökken, akkor kevesebb „kénsav eső.”
Kapcsolódó cikkek