Katalízis - studopediya
Az egyik leggyakoribb kémiai gyakorlati módszerek felgyorsítása kémiai reakciók kataliz.Katalizator - olyan anyag, amely részt vesz a több köztes szakaszban a reakciót, de hagyja változatlanul kémiailag.
Így például a reagáltatást az A2 + B2 = 2AV
Egy részét a katalizátor lehet alábbi egyenlet fejezi ki
Ezek az egyenletek lehet mutatni a potenciális energia görbe (ábra. 5.2.).
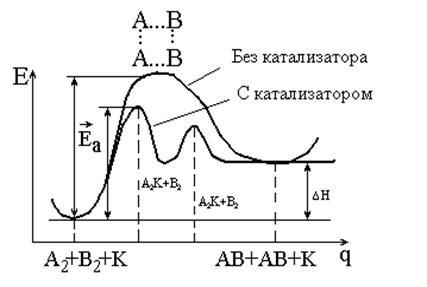
Ábra. 5.2. Az energia rendszer reakció előrehaladását
a katalizátor és katalizátor nélkül,
Tól 5.2 ábra látható, hogy:
1) katalizátor csökkenti az aktiválási energia megváltoztatásával a reakció mechanizmusa - átfolyik új szakaszt, amelyek mindegyike jellemző az alacsony aktivációs energia;
2) a katalizátor nem változtatja meg a DH reakciók (valamint DG, DU és DS);
3) ha a katalizált reakció megfordítható, a katalizátor nem befolyásolja az egyensúlyt nem változik az egyensúlyi állandó és az egyensúlyi koncentrációja a komponensek a rendszer. Ugyanilyen felgyorsítja mind a direkt és fordított irányú reakciót, ezáltal gyorsítja az idő, hogy az egyensúly eléréséhez.
Nyilvánvaló, hogy a katalizátor jelenlétében reakció aktiválási energiája csökken az értéket DEK. Mivel a kifejezés a reakció sebességi állandója (egyenlet 5.10) energiája aktiválási tartalmazza negatív kitevő, még egy enyhe csökkenés Ea okoz nagyon nagy növekedést a reakció sebességét :.
Hatása a katalizátor által a csökkentés Ea példázza bomlási reakcióját hidrogén-jodid:
Így a reakció energiacsökkentési
aktiválása 63 kJ, azaz 1,5-szerese, ez megfelel a növekedés a reakció sebessége 500 K 10 6-szor.
Meg kell jegyezni, hogy a pre-exponenciális faktor katalizátor reakció k0 k0 nem egyenlő 1, és általában sokkal kevésbé, de megfelelő csökkenését sebességét nem kompenzált rovására növeli Ea.
5. példa Az aktiválási energiája a reakciót katalizátor nélkül volt 75,24 kJ / mól, és a katalizátort - 50,14 kJ / mól. Hányszor a reakció sebességét növeli a katalizátor jelenlétében, ha a reakciót 25 0 C-on és pre-exponenciális faktor jelenlétében egy katalizátor csökken 10-szer.
Határozat. Jelöljük az aktiválási energia a reakció katalizátor nélkül az EA. és a katalizátor jelenlétében - az EA 1; megfelelő reakció sebességi állandókat k jelöli a K és 1 használatával az Arrhenius-egyenlet (5,9) (lásd 5.3 pont.), és figyelembe k0 1 / k0 = 10, azt találjuk:
Így, csökkentve az aktiválási energia 25,1 kJ katalizátor növekedéséhez vezetett a reakció sebességét 2500-szer, annak ellenére, hogy a 10-szeres csökkenést a pre-exponenciális faktor.
Katalitikus reakciók szerint osztályozzák, hogy milyen típusú katalizátor és típusa reakciók. Például, az aggregációs állapotától a reagensek és katalizátorok homogén katalízis osztva (katalizátor és a reagens alkotnak egy egyfázisú), és a heterogén katalizátor (és reagensek - a különböző fázisokban, van egy fázishatár között a katalizátor és a reaktánsok).
Példák a homogén katalízis lehet oxidációját CO CO2 oxigén jelenlétében NO2 (katalizátor). A mechanizmus a katalízis leírható a következő reakciók:
és a katalizátort (NO2) ismét részt az első reakcióban.
Hasonlóképpen ez lehet katalizálja SO2 oxidációs reakció SO3; ezt a reakciót használják a termelés kénsav „nitrogén” módszerrel.
Egy példa a készítmény heterogén katalízis SO3 származó SO2 jelenlétében Pt vagy V2 O5:
Ezt a reakciót szintén használják a termelés kénsav ( „kapcsolati” módszer).
Heterogén katalizátor (vas) is használják a termelés az ammónia a nitrogén és hidrogén, és sok más folyamatok.
A hatékonyság a heterogén katalizátorok általában sokkal nagyobb, mint a homogén. Ez az arány a katalitikus reakciók esetében egy homogén katalizátor függ a koncentrációtól és, abban az esetben a heterogén - a specifikus felülete (azaz, diszpergálhatóság) - a nagyobb ez, annál nagyobb a sebesség. Ez utóbbi annak a ténynek köszönhető, hogy a katalitikus reakció történik a katalizátor felületén, és magában foglalja a következő lépéseket adszorpciós (ragasztás) reagens molekulák a felületen; Miután a reakció, a termékek deszorbeáljuk. Ahhoz, hogy növeljék a katalizátor felületén a talaj vagy a készített speciális módszerek, amelyek nagyon finom porok.
A fenti példák is példák a redox katalízisben. Ebben az esetben, úgy járnak, mint katalizátorok jellemzően átmeneti fémeket vagy azok vegyületei (Mn 3+. Pt, Au, Ag, Fe, Ni, Fe 2O 3, stb).
A sav-bázis katalízis katalizátor működnek H +. OH - és hasonló részecskék - hordozói savas és bázikus jelleg. Így a hidrolízis reakciót
Ez gyorsított körülbelül 300-szor hozzáadásával bármely erős savak: sósav, hidrogén-bromid, vagy HNO3.
Nagy jelentősége van a katalízis biológiai rendszerekben. Ebben az esetben a katalizátort az úgynevezett enzimet. A hatékonyságát számos enzim sokkal nagyobb, mint a hagyományos katalizátorok. Például, a kötési reakciót a nitrogén ammóniává
Ipari heterogén katalizátort alkalmazunk formájában vasszivacs adalékanyagokkal oxidok és fém-szulfátok.
Amennyiben ezt a reakciót hajtjuk végre T „700 és P” 30 MPa. Ugyanez szintézis a csomók hüvelyes növények hatása alatt az enzimek normál T és R.
Katalizátor-rendszerek nem közömbös, hogy szennyeződések és adalékok. Némelyikük hatékonyságának növelése a katalízis, mint például a fenti példában a vas ammónia szintézis katalízis. Az ilyen adalékanyagokat az úgynevezett promotereket a katalizátor (a kálium-és alumínium-oxidok, a vas). Egyes szennyező anyagok, ellenkezőleg, elnyomja a katalitikus reakció ( „méreg” a katalizátort), ez a katalizátor mérgek. Például, SO3 szintézis Pt-katalizátor nagyon érzékenyek a szennyeződésekre, amely szulfidot tartalmaz kénatom; Kén mérgezi a platina katalizátor felületén. Ezzel szemben alapuló katalizátor V2 O5 nem nagyon érzékeny e szennyeződések becsület katalizátor fejlesztési alapuló vanádium-oxid tartozik az orosz tudós GK Boreskov.