Módszerek mikroszkópos szövettani készítmények
MÓDSZEREK mikroszkópos szövettani készítmények
MÓDSZEREK mikroszkópos szövettani készítmények
A fő módszer tanulmányozásának biológiai mikro-objektumok fény- és elektronmikroszkópos, amelyeket széles körben alkalmazták kísérleti és klinikai gyakorlatban.
Fénymikroszkópia. A tanulmány a mikroszkopikus szövettani használt hagyományos fénymikroszkópénál és fajták, amelyek a fényforrás különböző hullámhosszúságú. A hagyományos fénymikroszkóp fényforrás természetes vagy mesterséges fény (ábra. 2.1). A minimális hullámhossza a látható spektrum körülbelül 0,4 mikron. Következésképpen, a hagyományos fénymikroszkóp legkisebb feloldható távolság közelítőleg 0,2 m, és a teljes nagyítás (zoom lencse terméket növelése okuláris) lehet 1500-2500.
Így, fénymikroszkóppal látható nem csak az egyes cella mérete 4-150 mikron, de a sejten belüli struktúrák - organellumok felvételét. Ahhoz, hogy fokozzák a kontraszt mikroszkopikus festés használt.
Ultraibolya mikroszkópia. Ez a fajta fénymikroszkóppal. Az ultraibolya mikroszkóp használ rövidebb ultraibolya sugarak a hullámhossza mintegy 0,2 mikron. Felbontási távolság 2-szer kisebb, mint a hagyományos fény mikroszkópok, és körülbelül 0,1 mikron. Kapott az ultraibolya láthatatlan szem képe alakul át látható fény útján bejegyzése a lemezen vagy a speciális eszközök (foszfor képernyő, egy elektron-optikai átalakító).
Fluoreszcein (fluoreszcens) mikroszkópia. Fluoreszcencia jelenség abban rejlik, hogy az atomok és a molekulák számos anyag elnyeli rövid-
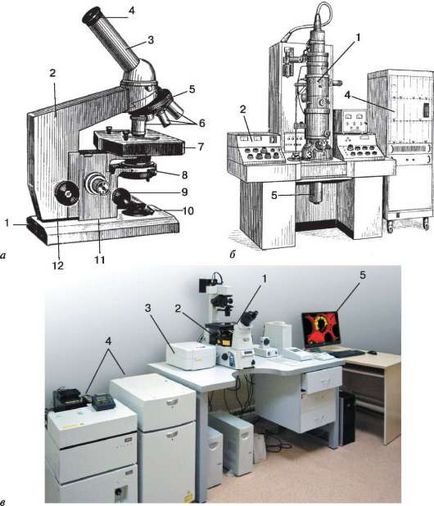
Ábra. 2.1. Mikroszkóp a biológiai kutatások:
3 - letapogató mozgató eszköze fénysugár a tengelyen X, Y, Z;
4 - a tápegység és a lézer vezérlőrackben; 5 - számítógépes képfeldolgozás számára
hullám sugarak izgatott. A fordított átmenet egy gerjesztett állapotból egy normál és a fénykibocsátás történik, de hosszabb hullámhosszon. A fluoreszcencia mikroszkóp fényforrások gerjesztésére használt fluoreszcens vagy KCE higanylámpával, ultramagas nyomáson nonovye rendelkező nagy fényerejű a spektrális tartományban 0,25-0,4 mikron (közeli ultraibolya sugarak) és 0,4-0,5 mikron (kék -Purple sugarak). a hullámhossz a fluoreszcencia mindig nagyobb, mint a hullámhossz a gerjesztő fény, így vannak elválasztva szűrők és tanult képet egy tárgy csak a fény a fluoreszcencia. Különbséget saját, vagy primer és indukált, vagy szekunder, fluoreszcens. Bármilyen sejt egy élő szervezet saját fluoreszcencia azonban gyakran rendkívül gyenge.
Elsődleges fluoreszcens vegyületek szerotonin, a katekolaminok (epinefrin, norepinefrin) szereplő idegi, zsír és más sejtek, szövetek fixálás után a formaldehid gőzt 60-80 ° C-on (Falk módszer).
A másodlagos fluoreszcencia keletkezik, ha feldolgozási termékek különleges festékek - fluorokrómokkal.
Vannak különböző fluorokrómmal, amelyek specifikusan kötődnek bizonyos makromolekulák (akridin narancs, rodamin, fluoreszcein, és mások.). Például, amikor termékeket kezelő DNS akridinnaranccsal és vegyületei sejtekben fényes zöld színű, és RNS-t és ezek származékait - a fényes vörös izzás. Sok színezékek, hogy lehet használni fehérjék azonosítására, lipidek, az intracelluláris kalcium, magnézium, és a nátrium. Így a spektrális összetételét a sugárzás hordoz információkat a belső szerkezet a tárgy és a kémiai összetétele. Opció módszere fluoreszcens mikroszkópia, amelyben mind a gerjesztési és emissziós fluoreszcencia jelentkezik az ultraibolya tartományban a spektrum, az úgynevezett módszer ultraibolya fluoreszcenciás mikroszkópia.
Ahhoz, hogy fokozzák a kontrasztot a tárgyak használt flyuorohromirovannyh kiviteli alakban konfokális optikai mikroszkóppal (lásd. Ábra. 2.1). Mivel a világítás használt sugárnyaláb monokromatikus fényt kis átmérőjű, amely létrehoz egy lézer forrás. Az egyes időpontokban a hangsúly a mikroszkóp kis területen (mennyiség) sejtek. A fénynyalábot mozgatni a tárgyról (objektumot vizsgál a tengelyek mentén X, Y, Z). Mindegyik fénynyalábot mozgatni egyik képsort kapunk információt a vizsgált szerkezet, található egy adott ponton (képernyő) szerint a szkennelési vonal (optikai cellában cut), mint például a lokalizáció a fehérjék álló mikrotubulusok egy sejtben. Minden információt kapott minden egyes ellenőrzési pont sejtek át a számítógépre van kombinálva egy speciális program és kimenetre a képernyőn, mint a kontraszt képet. Ezzel a módszerrel mikroszkópos információt szerezni sejt alakját, citoszkeleton, azok magszerkezetű, kromoszómák stb Egy számítógépes program segítségével alapján kapott minden egyes szkennelési vonal információt generál térfogati kép a cella, amely lehetővé teszi a sejt különböző szögekből nézve.
Fázis-kontraszt mikroszkóppal. Ez a módszer azért alkalmazzák, hogy a kontraszt a képeket átlátszó és színtelen nappali tárgyak láthatatlan alapján szokásos módszerekkel mikroszkópia. A módszer azon a tényen alapul, hogy a fény áthalad a szerkezet egy másik törésmutatójú, megváltoztatja a sebesség. Használható mikroszkóp optikai kialakítás révén nem konvertálja a szem áthalad a fázisváltó készítmény színtelen fény változásai az amplitúdója, azaz a. E. a kép fényerejét. fáziskontraszt módszer szemben vizsgálták festődő struktúrák miatt sajátos kör alakú nyílást helyezünk a kondenzátor, valamint az úgynevezett fázisú lemezen található a lencse. Egy változata, a fáziskontraszt módja egy eljárás, a sötét területen fázis-kontraszt, negatív, mint a pozitív fáziskontraszt képet.
Sötét látóterű mikroszkóppal. A sötét látóterű mikroszkóp csak a fény, amely diffrakciós (hajlítási hullámok) a struktúrák a készítmény nem éri el a lencse. Ennek oka az, hogy a jelen lévő különleges mikroszkóp hűtővel, amely megvilágítja a készítmény szigorúan ferde fény; gerendák irányítja a megvilágítóeszköz oldalon. Így, a mező úgy néz ki, sötét, és a finom részecskék a készítményben visszaverik a fényt, amely azután belép a lencse. A klinikán a módszert alkalmazzák a tanulmány a kristályok a vizeletben (húgysav, oxalát), bizonyítani spirochete, különösen Treponema pallidum, ami szifilisz, stb
Interferencia mikroszkópia. Faj fáziskontraszt mikroszkóp olyan interferencia mikroszkóppal, amelynek célja a kvantitatív meghatározása a szövet súlya. A differenciál interferencia mikroszkóp (Nomarski optikával) használnak, hogy tanulmányozzák a felületi topográfiájának sejtek és más biológiai objektumok.
Az interferencia mikroszkóp fénysugár a megvilágítóeszköz van osztva két áramra: az egyik áthalad a tárgy és a fázis ingadozások változik, a második az, megkerülve az objektumot. A prizmák a lencse mindkét gerendák szuperponálódnak egymásra. Ennek eredményeként, egy kép van kialakítva, azzal jellemezve, részletekben microentity különböző vastagságú és sűrűségű különböznek a kontraszt mértékét. A mennyiségi értékelését változások, és a koncentráció a szárazanyagban.
Mikroszkópia. A polarizáló mikroszkóp egy módosítása a fénymikroszkóp, ahol a két polarizációs szűrővel szerelt: egy első (polarizátor) - között a gerenda és a tárgynyaláb és a második (analizátor) - az objektív lencse és a szem. Keresztül az első szűrő halad a fény csak egy irányban, a második szűrő fő tengelye,
amely merőleges az első szűrő, és nem enged át fényt. Sötétlátóteres hatást kapunk. Tartalmazó struktúrák egy hosszirányban orientált molekulák (kollagén, mikrotubulusok, mikroszálak), és kristályos szerkezetet, képesek forgatni a tengelye a induló fénysugarak a polarizátor. Ha megváltoztatja a forgási tengelye a adatstruktúra jelennek világító sötét háttér előtt. Az a képesség, kristályok vagy parakristályos szerkezetek egy elágazási a fényhullám közös, és erre merőlegesen az úgynevezett kettős törést. Az ilyen fonalak képesek harántcsíkolt izmokat.
Elektronmikroszkóppal. Egy nagy előrelépést jelent a fejlesztés a szakterületen mikroszkóppal létrehozását és használatát egy elektronmikroszkóp (lásd. Ábra. 2.1). Az elektron mikroszkópot alkalmazunk az elektrondonor fluxus hullámok rövidebb, mint a fénymikroszkóp. Amint a feszültség 50 000 V hullámhosszú elektromágneses rezgések által indukált az elektronok áramlását, mozgó vákuumban, a 0,0056 nm. Elméletileg kiszámította, hogy felbontási távolság ilyen körülmények között lehet körülbelül 0,002 nm, vagy 0,000002 m, t. E. 100, 000-szor kisebb, mint a fénymikroszkóp. Szinte modern elektronmikroszkóp felbontási távolság körülbelül 0,1-0,7 nm.
A szövettani használják átviteli (áttetsző) elektronmikroszkóp (TEM), pásztázó (raszter) elektronmikroszkóp (SEM) és ezek módosításait. TEM lehet beszerezni csak egy sík kép egy mikroszkopikus tárgy vizsgált. Ahhoz, hogy a térbeli ábrázolás szerkezetének használt SEM generálására képes háromdimenziós képet. Pásztázó elektronmikroszkóppal működik beolvasásával elektronmikropróbás objektum vizsgálat alatt, azaz a. E. Egymást „érzi” élesen fókuszált elektronsugarat külön pont a felület. Egy ilyen tanulmány célja az úgynevezett pásztázó (olvasás), és a mintát, amely mozgatja mikroszonda - raszteres. Az így kapott kép jelenik meg a képernyőn, az elektronsugár ami mozog szinkronban mikroszonda.
A fő előnye a pásztázó elektronmikroszkópia nagy mélységélesség, széles körű folyamatos szórása nagyítás (a tízes több tízezer alkalommal) és egy nagy felbontóképessége. Modern megvalósítási módjai eszközök tanulmányozására egy tárgy felületét az atomi erő mikroszkóp és a pásztázó alagút mikroszkóp.
Elektronmikroszkópos alkalmazásával fagyasztási módszer - forgácsolás használják, hogy tanulmányozza a részletes szerkezetét membránok és intercelluláris kapcsolatok. fagyasztva alacsony hőmérsékleten termelő chipek sejtek (-160 ° C). Abban a vizsgálatban, membrán hasítási sík áthalad a közepén a lipid kettősréteg. Továbbá, a belső felületén a kapott membrán félből porlasztott fémek (platina, palládium, urán), tanulmányozzák őket, és TEM mikroszkópos felvételeket.
cryoelectron mikroszkópos módszerrel. Gyors fagyasztott vékonyréteg (körülbelül 100 nm) a szöveti mintát viszünk egy mikroszkopikus rács és vizsgáltuk vákuumban mikroszkóp -160 ° C-on
elektronmikroszkópia módszer „fagyasztás - marás” használják a tanulmány a külső felülete a sejtmembránok. Gyors fagyasztás a sejtek nagyon alacsony hőmérsékletű osztott blokk penge. A kapott kristályokat jeges vizet szublimációval eltávolítjuk vákuumban. Ezután a sejt részeket tarkított porlasztással egy vékony film egy nehézfém (például platina). A módszer lehetővé teszi, hogy azonosítsa a háromdimenziós szerkezetek a szervezet.
Így azok az eljárások fagyasztás - fagyasztás és a spallációs - marató lehetővé teszik, hogy tanulmányozza rögzítetten sejteket abban képződése nélkül leletek által okozott fixálás.
Módszerei festés nehézfémsók, hogy lehetővé tegye egy elektronmikroszkóp, hogy vizsgálja az egyes makromolekulák - DNS, nagy fehérjék (például miozin). Amikor a negatív-festéssel vizsgálatban makromolekuláris szerelvények (riboszómák, vírusok), vagy protein szálak (aktin filamentum).
Elektronmikroszkópos metszetek kapott krioultramikro-Tomii. Ebben a módszerben darab szövet rögzítése nélkül, és töltés a nehéz közepes gyorsan lehűtjük folyékony nitrogénben -196 ° C-on Ez biztosítja fékezés a metabolikus folyamatok a sejtek és az átmenet a víz folyékony halmazállapotból szilárd. Ezután vágjuk blokkok ultramikrotóm alacsony hőmérsékleten. Ezen előállítási eljárás szakaszok általánosan használt meghatározására enzimaktivitás, valamint immunkémiai reakciók. Azonosításához alkalmazott antigének kötött antitestek kolloid arany részecskék, amelyek könnyen azonosítani a lokalizáció a hatóanyag.
Módszerek EHV mikroszkóppal. Egy elektron mikroszkóp gyorsító feszültség legfeljebb 3 000 000 B. Egy előnye ezeknek a mikroszkópok, hogy lehetővé teszik, hogy vizsgálja meg a tárgyak nagy vastagságú (1-10 mm), mivel kevésbé elnyeli a tárgy nagy energiájú elektronok. Sztereoszkopikus fényképezés lehetővé teszi, hogy információt kapjon a háromdimenziós szervezet a sejten belüli struktúrák nagy felbontású (0,5 nm).