Tulajdonságok szerkezeti izomerek
"Tautos" - ugyanaz, "Meros" - a részesedése a (görög)..
Tautoméria - dinamikus jelenség a reverzibilis váltást izomerek, előforduló a törés és a kötés képzésében és elmozdítása atomok kíséretében (gyakran egy proton), és a csoportok az atomok kevesebb.
Izomer formái - tautomerek.
Ellentétben szerkezeti izomerek, tautomerek, mint általában, nem létezhet egymástól elválasztva. Függetlenek a vétel nem lehetséges.
A fő jellemzője az, tautomer anyagok kétértelmű válasznak - a képesség, hogy két sor származékok eredményeként különálló és független választ egyensúlyi két izomer formában a vegyületek.
1. keto-enoltautoméria:
2. Amid-imidolnaya tautomerizmust:
3. A gyűrű-lánc egyensúlyi tautomeriya- lineáris és gyűrűs (hemiacetál formája)
- fajta sztereoizoméria, amely különbség határozza meg a térbeli elrendezése a szubsztituensek a molekulák a pár síkjához képest a kettős kötés vagy a ciklus.
Annak a ténynek köszönhetően, hogy a molekulák ezeknek a vegyületeknek a szabad forgását az atomok körül # 963; -kötéseken (cikloalkánok) és képest π-kötések (alkének) lehetetlen.
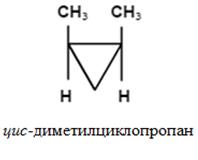
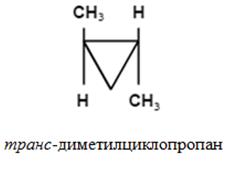
Z, E-nevezéktan (tri- és tetraszubsztituált alkének).
Konfigurációjú izomer határozza meg a relatív helyzetét a vezető szubsztituensek. Az egyik oldalon a sík - Z-izomer; ellentétes - E-izomer.
Annak meghatározása, hogy elsőbbséget alapul a rendszám az elem. Abban az esetben, azonos atomok csoportok a „második héj” atomok:
Abban az esetben, csoportok különböző típusú kapcsolat eltöltött növekszik a soraiban:
-CH2 OH <-COH Mivel a távolság a szubsztituensek a molekulák különböző izomerek, míg az utóbbi lényegében különböznek a kémiai és fizikai tulajdonságok. Ezek osztható és létezik külön-külön. Az átmenet egyik izomert a másik izomerré - izomerizáció történik általában melegítéssel, vagy besugárzással. - fajta sztereoizoméria, amely különbség határozza meg a térbeli elrendezése a szubsztituensek a molekulák, eredő szabad forgását körülbelül # 963; -kötéseken. Ezek az izomerek különböznek a stabilitást. Stabilabb konformációk rögzített fizikai-kémiai módszerekkel nevezzük konformerek. Konformer- egy olyan molekula, egy olyan konformációban, ahol a atomok spontán után visszatért kisebb változtatásokat. A fényképek konformereknek - Newman vetítés: Minél nagyobb az erő a kölcsönös taszítása hidrogénatomok, annál nagyobb a rendszer energiája; Ezért gátolta konformáció találkozik minimum potenciális energia a molekula. Figyelembe különböző konformáció, molekulák kémiailag homogén; konformációs izomerek nem jellemző. Azonban, bizonyos esetekben (szoros csomagolása molekulák), osztható különböző formái. Konformációk Bioorganic molekulák (enzimek, vitaminok, fehérjék, nukleinsavak) meghatározó szerepet játszanak a megnyilvánulása a biológiai aktivitását az utóbbi. Koformatsii egy sor ciklusos szénhidrogének: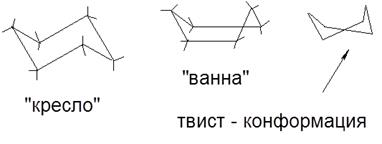
Háromdimenziós struktúrákat ciklusos vegyületek tartalmazhatnak különböző szubsztituenseket a természet a helyzet:
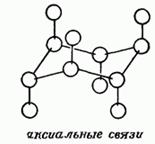
és - axiális (váltakozva irányított ellentétes irányban a gyűrű síkja)
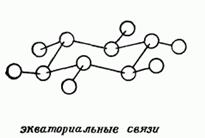
e - egyenlítői (sugárirányban távol a sík és váltakozva ellentétes irányban)
Egyes szerves vegyületek optikailag aktívak. Képesek megváltoztatni a polarizációs síkját a fény, amint az áthalad a minta anyaga (1815, J. Bio).
Fény - elektromágneses hullámok, rezgések merőleges a terjedési iránya. A természetes (nap) fény, ezek a rezgések fordulnak elő különböző síkokban.
Az optikailag aktív vegyületeket a polarizáció síkja forgatjuk egy bizonyos szögben, hogy a megfelelő (jobbraforgató) vagy balra (balra forgató).
Az izomerek forgatni a polarizáció síkja különböző irányokba, de azonos szögben - antipódokra (enantiomerek).
A racém keveréket (racemát) - keveréke egyenlő mennyiségű bal- és jobbra forgató izomerek. Racemátot optikailag inaktív.
Az optikai aktivitás jellemző tartalmazó vegyületek
sp3 -Hybrid atom (volumetrikus molekula). Ha az ilyen atom szénatomhoz négy különböző szubsztituens merülnek izomer párokat, amelyben az izomerek a molekulák térbeli elrendezésben egymáshoz, valamint, hogy az összefüggés egy tárgy és egy tükörkép.
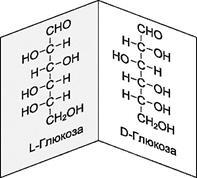
Annak érdekében, hogy összekapcsolja az épület a forgatás, azt kéri, hogy válasszon egy kapcsolat szabványos és összehasonlítani őket olyan vegyületek királis centrumot tartalmazó. A standard, választották
2,3-dioksipropanal (gliceraldehid):
Besorolásához sztereoizomerje kell meghatározni abban részesítendő szubsztituensek (sorszáma az elem - mint abban az esetben a Z, E-izomer). megfigyelő tekintetét mentén irányul C tengely Jr. szubsztituens (H). Miután ezt az orientációt, úgy néz ki, mint a három szubsztituens van elrendezve egy sorban, egy irányban a legrégebbi a legfiatalabb. A sluchaeR-konfigurációban, ezt az eljárást megfelel a menetirányra az óramutató járásával megegyező irányba a sluchaeS konfigurációban - az óramutató járásával ellentétes.
Ha a molekula tartalmaz több királis centrumot, a izomerek száma növekszik, és egyenlő 2 N. ahol n - királis centrumok száma.
Ellentétben a szerkezeti izomerek enantiomerek azonos egymással a legtöbb tulajdonságait. Ezek különböznek a csak a kölcsönhatás a síkban polarizált fény és a kölcsönhatás olyan anyagokkal, amelyek szintén királis.
A szervezetben, reakciók fordulnak elő részvételével biokatalizátorok - enzimek. Enzimek épített királis molekulák # 945; aminosavak. Ezért, úgy működnek, mint királis reagensek, amelyek érzékenyek a kiralitása kölcsönhatásban áll a szubsztrátok (sztereospecifitása biokémiai folyamatok). Ez vezet az a tény, hogy a királis természetes vegyületek kerülnek bemutatásra, mint egy szabály, hogy csak egy sztereoizomer formában (D-szénhidrátok, L-aminosavak).
Sztereospecifitást alapjául szolgál az egyik megnyilvánulása a biológiai hatás az enantiomerek, míg a másik izomer inaktív lehet, és néha különböző, vagy akár ellentétes hatásokat.
1.3 A kémiai kötés szerves vegyületekben
Összhangban kvantum kémiai reprezentációk szénvegyületek kell lennie kétvegyértékű.
Azonban, a legtöbb a csatlakozások szénatom van egy vegyértéke a IV. Ez akkor fordul elő miatt leválasztással ( „szétválasztás”) egy pár elektronok 2s alréteg.
Ha kémiai kötés kialakulása az energia felszabadul, így a megjelenése két új lehetőségeket vegyérték felszabadulásához vezet a további energia (1053,4 kJ / mól), amely nagyobb, mint az energia fordított gőzölés 2s elektronok (401 kJ / mól).
Különböző alakú pályák (s, p) a kialakulását a kötés keverék, amely új egyenértékű hibridizáljuk pályák (hibridizáció elméleti L.Poling, D.Sleter, 1928-1931.). A koncepció a hibridizáció csak a molekulák, de nem az atomok és orbitális hibridizáció meg csak, és nem elektronok rájuk.
Eltérően a nem-hibridizált s- és p-pályák hibrid orbitális poláros (elektronsűrűség eltolódik), és képes képezni erősebb kötések.