Lab k2 (kész)
Lab szám K2
MEGHATÁROZÁSA ÁLTAL Rydberg állandó emissziós spektruma hidrogén
A cél a munkát. meghatározzák a frekvenciák spektrális vonalak a látható spektrumban, és emissziós hidrogén értékének kiszámításához a Rydberg állandó.
Felszerelés. hidrogén-lámpa, neon lámpa, a lencse, a monokromátorral 2 vagy PA-MUM.
Rövid elméleti információk
Fénykibocsátás történik atomok részletekben - QUANTA a elektron egy atom az átmenet az egyik egyensúlyi állapotból a másikba, több energiát alacsony. A fotonenergia egyenlő H , ahol h - Planck állandó, - a frekvencia a kibocsátott sugárzás.
Szerint kvantummechanika, frekvencia függ az energia a stacionárius állapot az elektronok az atom az alábbiak szerint:
ahol En és Ek - a kezdeti és a végső energiája stacionárius állapot az atom, illetőleg; k - száma az energia szintjét az atommal, amelyhez elektron átmenet után végezzük a sugárzás, n - a szint száma, amelyből egy elektron mozog kibocsátása alatt elektromágneses energia atom. R - Rydberg állandó; c = 3 ∙ augusztus 10 m / s - a fénysebesség vákuumban.
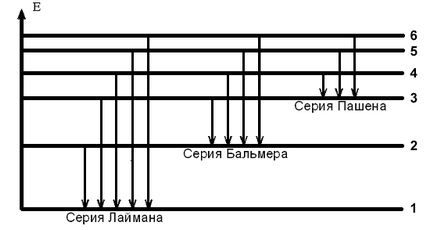
hidrogén spektrális vonalak vannak csoportosítva sorba (lásd. 1. ábra).
Lyman sorozat vonalak történik az átmenet az elektronok a magasabb energia stacionárius állapot az első. Az ezeket a sorokat a k = 1, n = 2, 3, .... és a frekvenciák a láthatatlan ultraibolya tartományában a spektrum.
A vonalak a látható részét a spektrum - Balmer sorozat - jellemzi elektron átmenetek a államok a számok n = 3, 4, 5, ... olyan állapotban a k = 2 az átalakulása egy elektront egy állami n = 3 állapotba k = 2 megfelel a piros vonal spektrum, az átmenet a állapotát n = 4 állapotban a k = 2 - zöld-kék vonal, és egy átmenetet egy állami n = 5 állapotban a k = 2 - lila vonal a spektrum hidrogén.
Transitions elektronok szintben száma k = 3 a magasabb energia szintje formájában egy sor olyan Paschen vonalak, amelynek frekvenciák vannak a láthatatlan infravörös tartományban és a t. D. Minden spektrális vonal megfelel egy bizonyos frekvencia és hullámhossz , rokonságban
Ebben a cikkben, azt kell kísérletileg meghatározni a frekvenciákat a három vizsgált vonalak a Balmer sorozat. A kapott eredményeket, a következő képlettel számítjuk (1) Rydberg állandó.
Frequencies hidrogén-spektrumot egy monokromátorral UM-2, optikai rendszer ábrán látható. 2. A fény hidrogénatom lámpa 1 által van fókuszálva lencse 2 ra a belépő rés monokromátor 3. A rés van a hangsúly a 4 lencse, és belép a mozgatható részt a monokromátor, az úgynevezett kollimátor. Forgassa a gombot 5 lehet mozgatni az optikai tengely mentén a kollimátor. Coming lencsét 4 párhuzamos fénynyalábot esemény a 6 prizma és egy spektrumot. Lens 7 koncentrál a spektrumot a területen a megfigyelés. Nyomon követése spektrum szemlencsén keresztül 8. A szemlencse egy recézett gyűrűt, amely lehet elérni elforgatásával a legélesebb minta megfigyelés spektrum. Alján a rés 3 mikrométercsavarral, amely lehetővé teszi, hogy módosítsa a rés szélessége.
képet a spektrum megfigyelt bevezetésével a közepén a látómező a jogot a területen. Erre a dobot 9 elfordul jobbra a távcső monokromátor. A dobot, amely egy skálával, amely lehetővé teszi, hogy meghatározzuk a forgatást fokokban. A skálaosztását 2. Count spektrális vonalak termelt idején ötvözi a vonal egy nyíl - mutatót a közepén a látótér. Arrowhead és egy kép a spektrum figyelni kell egyformán élesen. Ehhez állítsa be a szemlencse éles nyíl-mutató órát, majd forgassa el a gombot az 5. elérni éles képet a spektrum ellenőrzés. A belépő rés van egy szelep 10, megszakítva a fényáram. A dolgozó helyzetben a csappantyú kell nyitni.
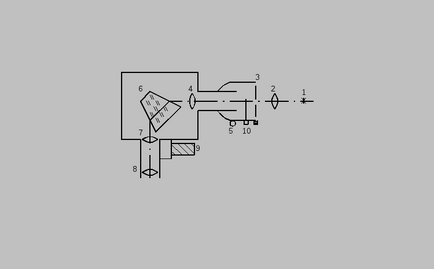
A skála dob sorolt frekvenciákon. Erre a célra, egy jól tanulmányozott neon emissziós spektruma, táblázatban leírt. 1.
Leírás neon emissziós spektrum
Megjegyzés. Annak érdekében, hogy a megfigyelés elősegítése a piros vonal 1, a piros és a narancssárga vonal a 2. és sárga vonal 3, az összes piros és sárga neon spektrum látható egy külön ábrán a laboratóriumi asztalra.
Az, hogy a teljesítmény
Állítsa be az optikai sínre glimmlámpával sugárzás és irányítsa rá a belépő rés monokromátor. Állítsa be a minimális rés szélessége. Megfigyelése révén a szemlencse spektrumát neon, egyesítik a nyíl mutató egyes vonalak táblázatban ismertetett. 1. Az elfordulási szög a dob skála és a hullámhossz a táblázat. 1 az egyes vonalak rögzítik a táblázatban. 2. Mozgó a fényes vörös, narancs és sárga vonalak gyenge vonal, a zöld és a kék régiók a spektrum, szükség van, hogy fokozatosan növelje a rés szélessége.
Száma neon színképvonal
A táblázat adatai alapján. 2, hogy egy kalibrációs görbe a forgási szög a frekvencia. Ha grafikusan ábrázoljuk tartsák be a következő skála szerint. A tengely „frekvencia” 1 cm kell felelnie ∙ 10 10 12 Hz, a tengelyen „szög forgási” 1 cm kell felelnie 100 dob forgása.
Felvett a táblázatban. 3 leolvasás a skála dob megfelelő minden egyes megfigyelt spektrális vonalak hidrogén.
A felépített kalibrációs görbe meghatározásához frekvenciaspektrum vonalak hidrogén.
Ábra szerint. 1 készlet számok n és k szintjét a kezdeti és a végső elektron állapot minden sorban spektrumát hidrogénatom. Az eredményeket a táblázatban. 3.
A képlet szerint (1) kiszámításához Rydberg állandó minden sorozat Bolmera vonalon. Az átlag értékét a Rydberg állandó, és összehasonlítjuk a táblázatos értéke R = 1,097 ∙ július 10 m -1.
Miért kalibrálni a spektrumot venni neon? Tudom használni egy sor más elemeinek a sugárzás?
Sorolja a sorozat a hidrogén-spektrum. Melyik átmenet felel meg a fejét minden sor a sorozat?
Mi határozza meg a határ a sorozat? Miért van a határ sorozat intenzitása csökken?
Hogyan átmenetek megfelelnek vonalak a látható része a spektrum hidrogén? Mi a spektrális sorozat?
a laborba szám K2
Detlaf AA Course of Physics: Proc. 3 Vols. T. 3 / AA Dettlaff BM Jaworski, L. B. Milkovskaya. - M. 1979.
Zisman, GA pálya az általános fizika: tankönyv. 3 t. T. 3 / GA Zisman, OM Todes. - M., 1974. - S. 267.
Savelyev IV pálya az általános fizika: Textbook. 3 Vols. Vol.3 / IV Savel'ev. - M., 1979. - S. 305.