Időszakos Law, stb
Az időszakos törvény és a periódusos rendszer elemei.
Elektronikus családtagok és azok elrendezése a periódusos rendszerben DI Mengyelejev.
Periodikusan változó tulajdonságait az elemek és ezek vegyületei.
Időszakos törvény és a periódusos rendszer elemei.
Periodikus törvény fedezte fel Mengyelejev 1869-ben. Törvény meghatározza a kapcsolat a tulajdonságok és az atomi tömeg az elem. A fejlesztés a kvantummechanika, a periodikus törvény kapott szilárd elméleti alapot és egy új készítmény.
A tulajdonságait egyszerű anyagok, valamint az alakját, valamint tulajdonságait a vegyületek egy periodikus függvény a töltés mennyisége atommagba.
Grafikus kijelző a periódusos törvény Mengyelejev-féle periódusos rendszer elemeinek nevezzük.
Felépítése a periódusos rendszerben.
A periódusos rendszer elemeinek áll időszakok csoportok és alcsoportok. Az az időszak az úgynevezett sorszámát elemeket elrendezni, hogy a növekvő felelős a sejtmag az atomok, az elektron konfiguráció, amely változik 1 ns Dons 2 p 6 (ilins 2 az első időszak). Időszakok kezdve S-elemek és a zakanchivayutsyap-elem. (Az első időszak -s-elem). Kis időszakok 2, és tartalmazzák 8 elemek hosszú ideig - 18 és a 32, a hetedik időszakban továbbra is hiányos.
Csoportok - egy függőleges sorokban elemek, amelyek azonos kialakítással a vegyérték elektronok. Különböztesse a fő (A), alcsoportok és az oldalsó (B) alcsoport. Elements található egy és ugyanazon csoportban ugyanaz a konfiguráció vegyérték elektronok tehát hasonló kémiai tulajdonságokkal. Ezek az úgynevezett „analóg elemeket.”
Tekintsük a kapcsolat a helyzetben az elem a periódusos rendszerben, és annak elektronikus atomok.
ELEKTRONIKUS család elemei és azok helyét a periódusos rendszerben DI Mengyelejev.
Attól függően, hogy a koka energia szintalatti töltött utolsó, 4 családok elektronikus elemek: s, p, dif, amelyek elfoglalják egy bizonyos helyzetben a periódusos rendszerben az elemek.
1. s-elemek - családtagok, akik a töltés az elektronikus szintje az elektronok, az utolsó elektron megy vneshniys felületről. Ezek az első csoport a fő csoport és a második csoport a fő csoport (ez is otnositsyaHe). A maximális számát elektron-nas alréteg két, így minden időszakban a DVAS elem és a külső energia szint, amely 1 vagy 2 elektront.
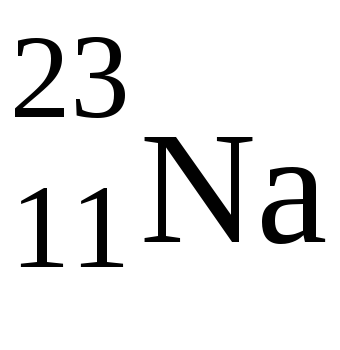
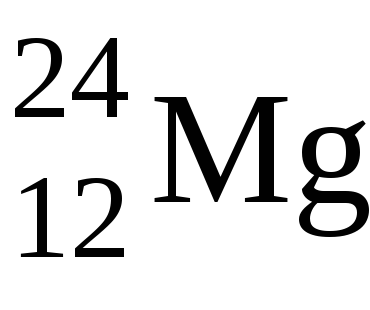
Ebben az esetben a nyújtás lesz a s-elektronok, rendre egy elektront az elektron atomaNa u2 y atomaMg.
2. p-elemek utolsó elektron megy NAP-szintalatti a külső réteg. Ezek az elemek úgy vannak elrendezve sIIIpoVIIIgruppu fő alcsoportja az egyes időszakok. Számuk 6 közötti időszakban, mint a maximális számú elektron-NAP alréteg egyenlő 6.
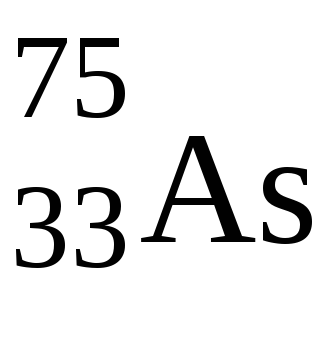
Ebben az esetben, a vegyérték elektronok 2 p 3. 4S konfiguráció poetomuAsmozhet mutatnak oxidációs állapotát -3 és +5. Tipikus oxidációs állapotok érte a -3, +3, +5.
3. Ud elemek zapolnyaetsyas első alréteg külső réteg és az utóbbi egy elektron-nad alréteg predvneshnego urovnya.d-oldali elemek alcsoportok a periódusos rendszer. Ud-slip elemek lehetséges s-elektron szintet a külső alréteg svobodnuyud orbitális predvneshnego szintet, ha azt energetikailag kedvező. Ezek az elemek a külső szinten 1 vagy 2 elektront. UPdnablyudaetsya dupla ugrás, ő kívülről nem elektronokat.
A maximális száma elektronok d-alréteg 10, de mivel a negyedik periódus minden egyes időszakban a 10d-elemek.
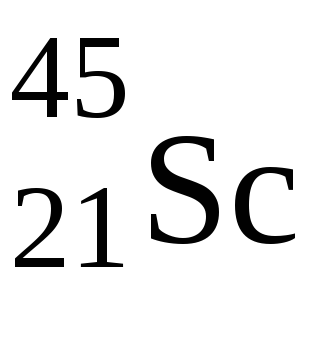
Ebben az esetben az első tele 4s-szintalatti, és csak ezután 3d-szintalatti. Ez az elem vegyérték elektronok vannak konfigurálva, 3d 1 4s 2. poetomuScimeet jellemző +3 oxidációs állapotban van.
4. f-elemeket nevezzük elemek kitöltése során az elektronikus szinten, az utolsó elektron megy Naf-alréteg predpredvneshnego szinten. Ezek közé tartozik a lantanidák és aktinidák.
A maximális az elektronok száma az F-alréteg 14, azonban azokban az időszakokban a 6. és 7., a periódusos 14f-elemek.
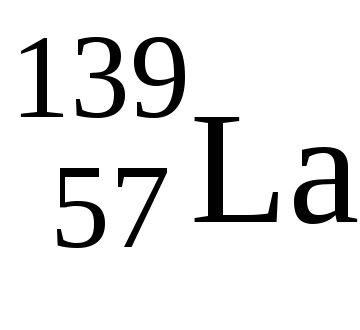
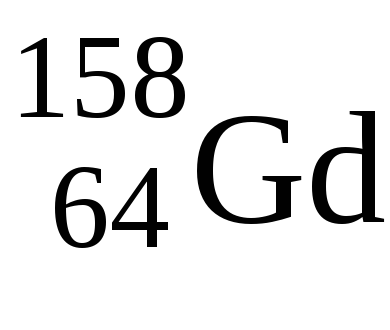
A Lavalentnye elektronok van egy konfigurációs 5d 1 6S 2 - tipichnyyd-eleme vegyérték elektronok, mint uGdkonfiguratsiya 5d 1 6S 2. Csak ezután töltjük 4f-alréteget, így mindkét eleme a +3 oxidációs állapotban.
Időszakos tulajdonságainak változását az elemek és ezek vegyületei.
A jelenlegi készítmények periodikus törvény tulajdonságai elemek periodikus töltésétől függően a nucleus összes atom.
Vegyünk néhány jellemzője az elemek.
Mivel a hullám természete elektronok, az atom nincs élesen meghatározott határok, így a koncepció a méret az atom nem szigorú, és számos módszer meghatározására sugara az atom. Jelenleg az összes elem fémes és kovalens kötés orbitális sugarak ajánlott. A orbitális sugarak. - a távolság a atommag a maximális sugárirányú eloszlásfüggvénye a valószínűsége a legújabb atomi pályák által lakott elektronok. Például, réz atom - a távolság az atommag, hogy a maximális elektron sűrűség 4s-pályák.
Függése atomrádiuszok a felelős az atommag periodikus jellegű (ábra. 12.)
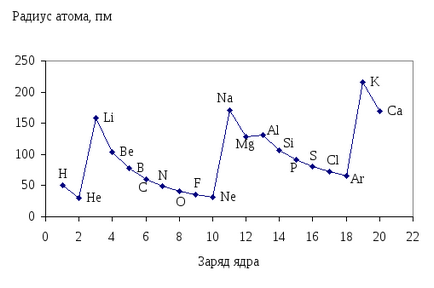
Ábra. 12. A függőség a orbitális sugara az atomok a atomszámú elemek.
Az időszakon belül növekvő sorszámmal az atom mérete csökken, mert a nukleáris töltet nőtt, és a szám az energia szintje állandó marad. A nagyobb a töltés a mag, a több elektront vonz a sejtmagba, ami a csökkenése atom nagyságát. Különösen jól megfigyelhető IIiIIIperiodah.
Az orbitális sugarak atomok IIiIIIperiodov elem (pm).
Ez a minta növekedésével magyarázható számának elektronhéjak és növeli a eltávolítása a külső elektronok a magból.
2. Az ionizációs energia.
Ionizációs energia az úgynevezett szükséges energia egy elektront távolítanak el egy atom, ion, vagy molekula, gázfázisban a t = 0 K közlése nélkül felszabadult elektron kinetikus energia. SimvolomNion jelöli ionizációs energia és expresszálódik kJ, vagy a J. eV.
1 eV - energia által megszerzett elektron a gyorsuló elektromos mező a potenciális különbség 1 V (1 eV = 96,5 kJ)
Ionizációs energia, kifejezett elektronvolt számszerűen egyenlő az ionizációs potenciál az atomok, kifejezett voltban.
Ionizációs potenciálja atomok ennek az elemnek a legkisebb feszültség mező, amelynél az elektron sebessége, elegendő lesz ahhoz, hogy ionizálja az atomokat. Minden további elektron ki nehezebb, azaz a N1 <Н2 <Н3 <…<Нn .
Nion mennyiség jellemzi a képessége az elem elektrondonor, azaz a Ez jellemzi a helyreállító tulajdonságait. A mensheNion. A magasabb redukáló elemek tulajdonságai. Ábra. 13.pokazana függése az első ionizációs energia az atom-elementovI IIIperiodov meglöki a atommagba.
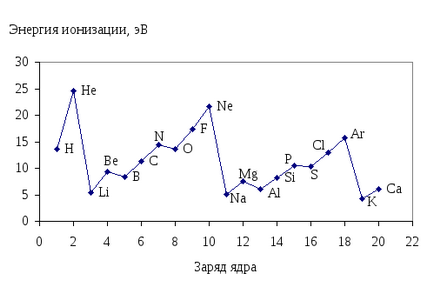
Ábra. 13. A függőség az első ionizációs energia az atomok az elemek az I-IIIperiodov hátba atommagba.
Adatok összehasonlítása ábrán látható. 13pokazyvaet hogy velichinaNion egy periodikus függvény a felelős a atommagok elemek.
Közötti időszakban a növekedés az atommag töltés ionizációs energia növekszik, és a csoporton belül - csökken.
Az első ionizációs energia az atomok elemek IAiIIA csoportok eV.
A legerősebb redukálószer Fr.
3. Az elektron-affinitása energia - az energia, amely felszabadul, amikor csatlakozott az elektronok gerjesztett atom, ion vagy gyök.
Ez az energia jellemzi oxidatív tulajdonságok az elem, azaz a képességgel, hogy csatolja az elektronok.
Ebben az időszakban egyre atommag díj energia növekszik, és a csoporton belül - csökken, ahogy atomrádiusz növekszik. Ilyenformán tehát a nagyobb az elektron-affinitása, annál erősebb az oxidálószer egy tagja. A legerősebb oxidálószer F.
Meghatározni, hogy mi tulajdonságok leginkább jellemző ez az elem, definiáljuk elektronegativitási:
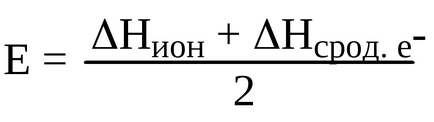
Definíció szerint Pauling elektronegativitási - a képessége atomok olyan molekula vagy komplex ion, hogy vonzzák a elektronokat vesz részt kötés kialakítása, azaz L. Pauling, elektrotritsatelnost utal atomok kapcsolódik a molekulához. Pauling elektronegativitási bevezetett relatív skálán, figyelembe fluor- EO egyenlő 4. A kifejezés elektronegativitási növekvő felelős a nucleus atomok növeljük, és egy csoporton belül - csökken.
IIiIIIperiodov elemek elektronegativitási szerinti Pauling (relatív egységekben)
Megfogalmazása szerint a periodikus törvény, periodikusan változtatjuk nem csak a tulajdonságait elemek, hanem a vegyületek tulajdonságait osztályok: oxidok, hidroxidok, hidrogén-vegyületek.
Például, a savas és bázikus tulajdonságait oxidjai és hidroxidjai cserélik függően változások a felelős az atommagok elemek.
Mint látható, növelésével a töltés a mag az atomok, alapvető tulajdonságait az oxidok és hidroxidok lecsökken, és a savat növekszik. Vegyük például IIIperiod:
NaOH- erős bázis
Mg (OH) 2 - gyengén oldható bázis
Al (OH) 3 - amfoter hidroxid
H2 SiO3 - enyhén savas
H3 PO4 - közepesen erős sav
H2 SO4 - erős savval
HCIO4 - nagyon erős savval
Azokban a csoportokban, ahol nőtt a nukleáris felelős atomok alapvető tulajdonságait-oxidok és -hidroxidok, amplifikált, és savas gyengült. Vegyük például egy IVA csoportba:
H2 SO4 - egy nagyon gyenge sav
H2 GEO3 Ge (OH) 4 - amfoter hidroxid túlnyomórészt sav tulajdonságainak
Pb (OH) 4 - amfoter hidroxid túlnyomórészt alapvető tulajdonságait
Minden kémiai vegyületek képződnek kölcsönhatása által az atomok, mint amelynek eredményeként egy kémiai kötés.