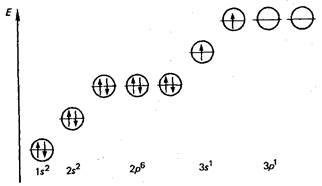
A normális állapotban az atomok ezen elemek van párosítatlan elektronok, de az átmenet az atomok
A normális állapotban az atomok ezen elemek van párosítatlan elektronok, de az átmenet az atomok gerjesztett állapotból az egyik s-vegyérték elektronok abból a p-alréteg.
Ez okozza kijelző oxidációs állapota +2. Például, egy magnézium-atom a gerjesztett elektronikus állam teljes képlete a következő.
Az oxidáció mértéke több mint két elemét IIA csoport nem mutatnak.
Motrya hogy a szám a vegyérték elektronok az atomok S-IIA csoport elemek egyaránt, magnézium-tulajdonságok és különösen berillium jelentősen eltérnek a alkáliföldfémek. Ez utóbbi elsősorban a jelentős különbség a sugarak atomok és ionok.
berillium tulajdonságok ellentétben annak a ténynek köszönhető, hogy megelőzte két-elektron vegyérték héjelektronokkal. Továbbá, a kémiai tulajdonságai a berillium és a magnézium eltérnek alkáliföldfémek, mert a kalcium, stroncium, bárium és rádium állnak d-orbitális közel az energia az NS-pályák.
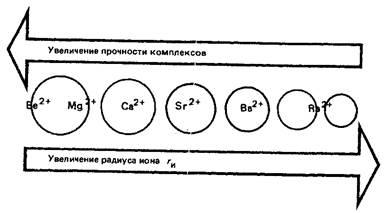
Berillium nagyjából hasonló az alumínium (átlós hasonlóságot a periódusos rendszerben). Radius atom és a berillium ion sokkal kevésbé, mint más s-csoport elemek. Ennek megfelelően, az ionizációs energia a berillium atom jelentősen magasabb, mint a többi S-IIA csoportbeli elemekkel. Ellentétben alkáliföldfém magnézium és berillium amfoter elemet, ez jellemzi nagyrészt kovalens kötést tartalmaz a többi elem. Normális esetben berillium formák nem egyszerű, és komplex ionok. Között Be + - Mg2 + - Ca2 + - Sr2 + - Ba2 + komplexek erőt oxigénnel és más ligandumok csökkent:
Az a képesség, BE2 + ion és képeznek stabil komplexeket képest Mg2 + ion oxigéntartalmú ligandumok, fluoridok és mások, vannak jelen az élő szervezetekben, ez nem okoz toxikus hatást ennek a kation.
Például egy berillium ion gátolja az aktivitását számos enzim, aktivált Mg-ion eredményeként helyettesítési magnézium-ionok a komplexeket enzimeket, nukleinsavakat és más bioligands tartalmazó foszfát-csoportokat:
Nagy szilárdságú berillium komplexek tetraéderes (SP3 hibridizációját pályák) foszfátok könnyen oldódnak, mint a kevésbé tartós magnézium oktaéderes komplexek (sr3d2 hibridizációját pályák). A helyettesítési reakcióban a berillium be a szervezetbe kiválasztani egy erős komplexet foszfor (foszfát-csoportokat). Ez viszont csökkenéséhez vezet a kalcium a szervezetben. Így, ennek eredményeként a lenyelése berillium betegség felmerül „berillium angolkór.” Mivel a fenti reakció reverzibilis, bevezetése nagy feleslegben a magnéziumsó eredményez elmozdulása az egyensúlyi balra (Le Chatelier-elv) és helyreállítása az enzim aktivitását.
Magnézium és berillium antagonistái, azaz. E. hozzáadása egyik eleme vezet elmozdulását a másik. Éppen ezért a sók a berillium mérgezés beadott felesleges magnézium-sók. Mivel a toxicitása berilliumvegyületek az orvosi gyakorlatban nem alkalmazhatók gyógyszerek.
Magnézium és berillium, jelentősen különböző méretű az atomok és ionok. A nagyobb méretű a magnézium-ion és az eredményeket egy nagyobb koordinációs száma az ionnal, általában egyenlő 6 komplex vegyületek bioligands. Kémiai kötések magnézium-ion-donor és oxigén és nitrogén atomok bioligands több ionos jellegű, mint a linkek berillium-ion. Ellentétben az összes többi kation IIA csoport, amely előnyösen a koordináció az oxigén atomokkal, Mg + ionokat előnyösen összehangolják nitrogénatomot.
Komplex magnéziumvegyületek fontos szerepet játszanak az élet a növények és állatok.
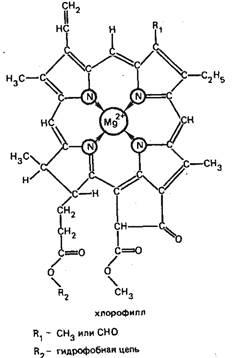
Például, a Mg2 + ion kelátképző pigment zöld növények - hlorofille- bioszervetlen vegyületet, amely fontos szerepet játszik a fotoszintézis:
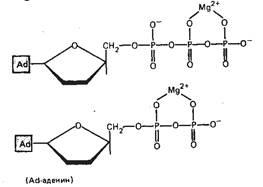
komplexképzési reakciót a következőképpen írható fel:
Mg2 + + ATF4- ↔MgATF2-
Mg2- + ADF3- ↔MgADF-
Sok enzimatikus reakciókban, amelyekben az ATP működik a donor a foszfát-csoport, az aktív formája ATP összetett MgATF2-. Meg kell jegyezni, hogy a koncentrációja Mg2 + ionok függ a stabilitást a riboszómák. Mg2 + ion képez hexakoordinált vegyületet szabályos szerkezet szemben a nagy mérete miatt Ca2 + ion.
Kalcium mutat koordinációs számú 6, 7 vagy 8 és formák aszimmetrikus komplexek. Egy lehetséges következménye a különböző biológiai szerepe ezeknek a sejteknek az élő szervezetben. Az a képesség, a Ca2 + ionok a komplex vegyületek különböző struktúrák lehetővé teszi számukra, hogy „alkalmazkodni”, hogy a környező donoratom bioligands és ez szolgál a hidat a ligandumok. Nyilvánvaló, hogy ez az, amiért a Ca2 + ion sokkal hatékonyabb, mint a magnézium-ion belép a hidat a két ligandum az extracelluláris térben.
Érdekes, az ion Ca2 + antagonista általában Mg2 + ion biokémiai folyamatokban. Ez azonban nem meglepő, hiszen a fizikai-kémiai jellemzőit ezen elemek jelentősen különböznek (= 148 kJ / mol, a különböző koordinációs számú, stb.) Így, Ca2 + ionok gátolják a sok enzim által aktivált ionok Mg2 +, például kálium-adenozin.
Antagonizmusa kalcium és magnézium ionokat nyilvánul az a tény, hogy ellentétben a magnézium-ion extracelluláris kalcium kationnal. Amikor a test megnyúlik túlzott mennyiségű magnéziumsók figyelhető gyorsított felhalmozódása kalcium csontból, és bizonyos proteinek.
Szinergizmus magnézium- és kalcium-ionok figyelhető meg a aktiválását bizonyos enzimek, de a legtöbb esetben a Mg2 + ion egy aktivátor az intracelluláris enzimek, és a kalcium-ion - extracelluláris.
Sokkal közelebb fiziko-kémiai tulajdonságai a magnézium-ion és mangán iont Mn2 +. Ennek következtében, az utóbbi gyakran működik fokozó ion Mg2 +. Például, mind ion aktivált enzimek, mint foszfatázok, és különböző más. Feltételezhető, hogy az aktiválási az enzim leucin-aminopeptidáz ionok Mg2 + és Mn2 + történik. Mivel a komplex képződését:
ahol M2 + -Mg2 + vagy Mn2 +.
Mivel a kalcium-A fizikai-kémiai jellemzők (ion sugara a ionizációs energia, koordinációs száma) közel van a stroncium és bárium, majd, mint egy szabály, az ionok ezen elemek szinergikus kalciumion. A hasonlóság mérete kalcium és a stroncium vezet állandó szennyeződések jelenlétére stroncium a szervezetben.