Oktatási könyv kémia
Középiskolai tanárok,
Pedagógiai hallgatók és diákok 9-10 osztályok,
Úgy döntött, hogy szentelje magát a kémia és a Természettudományi
TANKÖNYVKRITIKAI zadachnik MŰHELY LABORATÓRIUMI TUDOMÁNY történetek olvasására
§ 6.1. Solutions koncentráció, oldhatóság
Vannak olyan anyagok, korlátlan képes feloldódni egymással (például kénsav és víz vagy etil-alkohol és víz), és a korlátozott kapacitású. Ahhoz, hogy mennyiségileg a jellemzői egy anyagot feloldunk egy másik korlátozottan használják a kifejezést oldhatósága. amely azon koncentrációjaként fejeztük ki a telített oldat.
A telített oldatot kapunk, amikor a további oldódás a komponens végződik oldatban. A telített oldatot koncentrációja ez az összetevő maximális az adott körülmények között. A telített oldatot mindig egyensúlyban van a kristályos komponens (iszap). A koncentrációja ennek az összetevőnek az oldatot nevezzük annak oldhatóságától. Egy megoldás, amelynek során a koncentrációja a komponens kisebb, mint az oldhatóság, az úgynevezett telítetlen.
Egy oldat, amelyben az oldott anyag koncentrációja oldhatósága feletti úgynevezett túltelített. Az ilyen megoldások szokásosan úgy állítjuk elő túlhűtéssei az oldat alatt a hőmérséklet alatt, amely telítetté válik.
Néha azt sugallja oldódó fémek, például nátrium, vagy cink-a vízben a kénsav. De hívjuk feloldjuk kizárólag egy olyan folyamat, amelyben az oldott anyag nyerhető ki oldatot a kezdeti állapotban az ilyen egyszerű műveletek, mint az oldószer elpárologtatásával, átkristályosítással stb. N.
Oldhatóság kényelmesen kifejezve mól / l, de gyakran kifejezett tömeg, azaz. E. A számú gramm oldott 100 g telített oldattal. Néha oldhatósága kifejezni száma gramm oldott anyag 100 g oldószerben.
döntés
Definiáljuk a víztest 10 g telített nátrium-klorid-oldattal. Tegyük fel, súlya nátrium-klorid ebben az oldatban x g, akkor a víz térfogata egyenlő (10 - x), a
Alkotunk az arány:
Ennélfogva, a 100 / (10 - x) = 31,6 / x. és x = 2,4 g nátrium-kloridot. A víz tömege az oldatban: 10-2,4 = 7,6 g
A legtöbb anyag, oldhatósága nagymértékben függ a hőmérséklettől. Ahhoz, hogy meghatározzuk a oldhatóságát kikeresési táblák vagy oldhatósági görbék (ábra. 6.1) használunk különböző hőmérsékleteken.
Ha készítünk telített oldat hőmérséklete t2. anyagokat tartalmazó m2 g per 100 g vizet, majd lehűtjük a hőmérséklet t1. ahol m1 oldhatóság g, akkor a csapadék esik (azzal a megkötéssel, hogy nem túlhűtés nem képződik, és túltelített oldatot) tömege (m2 - m1) A
Hány gramm kálium-nitrátot kicsapódik lehűtése után telített 60 ° C hőmérsékletű oldatához kálium-nitrát vizes hőmérsékleten 20 ° C-on (lásd. Ábra. 6.1.)?
A legegyszerűbb kielégítő oldékonyságot oldott anyagokat határozza elpárologtatásával egy bizonyos mennyiségű oldatot, és a súlya a szárazanyag-tartalmú.
Példa. Számítsuk oldhatósága kálium-nitrátot vízben szokásos hőmérsékleten (20 ° C), ha a párolgás a telített oldatot 50 g száraz tömegére vonatkoztatva a sót találtuk 13,02 g
döntés
A súlya kálium-nitrát 100 g oldatot egyenlő 13,02 • 100/50 = 26.04 Ez a tömeg a kálium-nitrát per 100-26,04 = 73,96 gramm vizet egy telített oldatban. A arány:
Ahol x = 26,04 • 100 / 35,2 = 73,96 Ez az oldhatóság, azaz. E. Súly oldott anyag telített oldat 100 g víz.
Különböző oldhatósága anyagok alapján az egyik módja a tisztítás - átkristályosítással. A tisztítást csökken, hogy feloldja a szennyezett anyagnak egy alkalmas oldószerben, emelt hőmérsékleten, és az azt követő izolálása az anyagnak a tisztított kristályokat egy túltelített oldatból alacsonyabb hőmérsékleten.
Nézd ábra. 6.1. Amely anyagok átkristályosítással tisztíthatjuk? Lehetséges ezt a technikát, hogy tiszta nátrium-klorid?
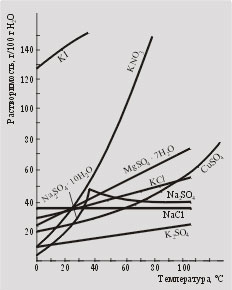
Ábra. 6.1.
Oldhatóság görbék anyagok
vízben különböző hőmérsékleteken
Telített oldatot elválasztás után az elválasztott kristályokat, úgynevezett mesterkeverék. Egyes szennyeződések eltávolítására a csapadékot. Ismételt átkristályosítás az az anyag tisztasága növekszik.
A oldhatósága Az anyag lényegében állandó átmenet egyensúlyi heterogén anyag kristályos fázisban oldatba. Ebben a tekintetben az oldhatósági értékeit két hőmérsékleten könnyen kiszámítható entalpia változás (termikus hatás), és az entrópia oldódás közben.
Hagyja, hogy a T2 hőmérséklet megegyezik a az anyag oldhatóságát P2. és oldhatósága hőmérsékleten T1 egyenlő P1. Alkot rendszert a két egyenlet két ismeretlennel c (H és S):
Ezután kiszámítjuk az N és S.
Példa. A oldhatósága ezüst-klorid vízben hőmérsékleten 10 ° C 6083 • 10 6 mol / l,
és 25 ° C-on - 1,249 • 10 ~ 5 mol / l. Számítsuk ki a változás az entalpia és entrópia feloldásával ezüst-klorid:
döntés
Alkotnak rendszert két egyenlet:
Találunk az első egyenletből:
és helyettesítse be a második egyenletet:
Így kaptunk pozitív entrópiaváltozás feloldódása után az ezüst-klorid, jelezve, hogy az átmenet az ezüst-klorid a kristályos állapotból az oldathoz (a formájában az ezüst-ionok és a klorid ionok) történik növekvő fokú zavar a rendszerben.
Find entalpia változást, behelyettesítve a értéke Srastv = 19,06 J / (K • mol) az egyik egyenletek, például:
Nrastv 27 = 997.048 + 298,2 • 19,06 = 33681 J / mol.
Amikor vízben oldjuk, az ezüst-klorid 33,68 kJ hő elnyelődik per 1 mol az anyag.
A kémiai összetétele a természetes vizek nagy jelentősége van az ember életében. A készítmény a különböző italok
vizet igényel, amelynek jól meghatározott tartalma a oldott anyagok.
Egyáltalán nem oldódó anyagok nem léteznek. Még a legtisztább víz a világon Bajkál sókat tartalmaz, amelyek mosni sziklák és a talaj áramlik a tóba a folyók. Az esővíz, és olvadt hó - nem teljesen tiszta víz, és a víz, amely 10-20 mg oldott 1000 g vízre. Azonban, az ilyen vizet lehet használni technikai célokra, desztillált víz, ha szükséges, például az előállítására kénsavoldatot autóakkumulátor.
Ha a víz egy ideig, hogy ellenálljon egy ezüst edényben vízben szinte teljesen elpusztított baktériumokkal. Fémes ezüst vízben oldjuk, és az ezüst-ionok erős baktericid hatása. Szántóföldi körülmények között hasznos inni vizet egy ezüst (ezüstözött) üveg. Az ezüst evőeszközök, amikor eszik is nagyon hasznos. Fertőtleníti víz és ezüst-klorid, bár gyakorlatilag nem oldódik vízben. Ezek a megoldások is kezelni a kis sebeket.
Természetes vizek különböző összetételű és mennyiségű oldott anyagot tartalmaz.
A koncentráció a szerves anyagok a folyó vízben körülbelül 20 mg / l, az óceáni - körülbelül 4 mg / L.
Listája forrásai a szerves anyag természetes vizekben.
Semmilyen esetben nem próbálja megjegyezni a numerikus adatokat fognak nyújtani az alábbiakban. Megpróbálja összehasonlítani a készítmény egyes vizek.
Kémiai összetétel Baikal víz (mg / l):

Bajkál-tó víz íze, mint a desztillált. Figyeljük meg, hogy a kis kloridion, vas-ionok a vízben! Próbálja megmagyarázni, hogy miért a Bajkál víz elég sok hidrogén ionok és kalcium-ionok.
Japán már többször felajánlotta, hogy megvásárolja a Bajkál víz és épít erre gázvezeték.
Néhány információ a Bajkál-tó. Életkor tó mintegy 25 millió évvel. Bajkál-tó - a legmélyebb víztömeg a Földön található a kontinensen. Maximális mélység - 1620 méter, a tó térfogat -. 23 000 km 3. A vizek Bajkál átlátszó akár 40 m-Bajkál-tó tartalmazza 1/5 a világ édesvíz tartalékok ..
Tó tartalmazó szervetlen sót olyan mennyiségben, a fenti 35 g / l lásd az ásványi. A telített oldatot ezen tavak nevezett sóoldattal mossuk. Mivel a magasabb viszkozitása vízben nagyon hőeloszlás a felületről a mélység, a víz nehéz, ezért a felső réteg a víz a nyáron lehet hőmérsékletre melegítjük 50 ° C-on, a víz a télen nem fagyasztható, még -20 ° C-on
Bajkál-tó szembeállítható más világhírű tó - a Holt-tenger (Izrael, Jordánia) Jeruzsálem közelében. A kompozíció a sók túlsúlyban magnézium-klorid (52%) és nátrium-kloridot (30%) is jelen vannak a kálium-klorid és a magnézium-bromid. Természetesen, az összes ilyen anyagok a vizes oldatban vannak jelen, mint ionok, de amikor azt mondjuk, „magnézium-klorid” „nátrium-klorid” és más sók, ez azt jelentette, sók, a víz elpárologtatása révén. Mivel a magas sótartalma a Holt-tenger vizei nem élőlények, kivéve néhány baktérium (megőrzött ókori). Holt-tenger víz és iszap part magas gyógyászati tulajdonságokkal. Sea levegő telített gőzök bróm és a jód.
Képzeld el, hogy dolgozik a központban ügynökség. Meg kell tudni, hogy milyen üdülőhelyek bizonyos betegségek kezelésére. Ez vonatkozik a készítmény ásványvizek. Mit szólsz, akik itt Pjatyigorszk és Kiszlovodszkba? Vagy lehet, hogy jobb, ha nem megy el, és igyál „Moszkva” ásványvíz?
Összetétel "Moszkva," ásványvíz (g / l):
Hasonlítsa össze a kompozíció a „Moszkva” ásványvíz Bajkál-tó víz összetételét. Ehhez megtalálni és kifejezni ugyanazt ion koncentrációja ugyanabban az egységben.
Kislovodsk híres források ásványvíz. A következő a kémiai összetétele az ásványvíz (g / l) az egyik forrás Kislovodska:
Mi a különbség a víz „Narzan”, és a „Moszkva” ásványi?
Új és elfeledett szavak és fogalmak
megoldás;
fázis összetétele változó;
oldószer;
oldott anyag;
tömeg frakció;
koncentrációja az érdeklődés;
mol, a moláris koncentrációja;
normál koncentrációja;
oldhatóság;
telített, telítetlen, túltelített oldatok;
átkristályosítással;
Az anyalúg
friss és sózott természetes vizekben.