Nitrogén és jellemzői
Összes nitrogén jellemzők
Nitrogén - a hetedik elem a periódusos rendszer. Symbol - N a latin «nitrogenium». Található, a második időszakban, VA-csoport. Arra utal, hogy a nem-fémek. 7. A nukleáris díjat.
A legtöbb nitrogén szabad állapotban. Szabad nitrogén a fő összetevője a levegő, amely 78,2% (vol.) Nitrogén. Szervetlen nitrogén-vegyületek nem fordul elő a természetben, nagy mennyiségben, kivéve a nátrium-nitrát NaNO3. alkotó vastag rétegben a Csendes-óceán partján Chilében. Talaj tartalmaz kis mennyiségű nitrogént, előnyös módon a salétromsav sói. De egy komplex szerves vegyületek - fehérje - nitrogén része az élő organizmusok.
Egy egyszerű anyagot nitrogén - gáz színtelen, szagtalan és a nagyon kevés oldódik vízben. Ez valamivel könnyebb, mint a levegő: tömeg 1L nitrogén 1,25 g
Atomi és molekuláris tömege nitrogén
Relatív atomtömeg elem az arány a tömege az elem az atom, hogy 1/12 tömegének szénatom. A relatív atomtömeg dimenzió nélküli és jelöljük Ar (index «R» - a kezdeti betű az angol szó relatív, ami azt jelenti, „relatív”). A relatív atomi tömege 14,0064 atomos nitrogén amu
Súly molekulák, valamint az atomi tömegegység kifejezve atomtömeg egység legyen. Molekulatömegű anyagok tömege a molekula kifejezve atomtömeg egység legyen. A relatív molekulatömeg anyag aránya a tömeg a molekula egy anyag 1/12 tömegének szénatomok, amelynek tömege 12 amu Ismeretes, hogy a nitrogén kétatomos molekula - N2. Relatív molekulatömege nitrogén molekula egyenlő:
a nitrogén izotópjai
A természetben van nitrogén formájában két stabil izotópok 14 N (99.635%) és 15 N (0,365%). Tömegük számok 14, illetve 15. Kernel nitrogénizotóp 14 N atomot tartalmaz hét proton és hét neutronok és az izotóp 15 N - a protonok száma és a neutronok hat.
Vannak tizennégy mesterséges nitrogén izotópok tömegszáma 10 és 13, és 16-25, amelyek közül a legstabilabb izotóp 13 Nc felezési ideje 10 perc.
nitrogén ionok
A külső energia szintjét a nitrogénatommal öt elektronok amelyek vegyértékkel:
Az áramkör szerkezet a nitrogénatomok az alábbiakban mutatjuk be:
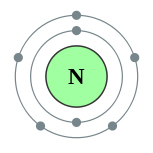
Ennek eredményeként a kémiai kölcsönhatás nitrogén elveszíthetik vegyérték elektronok, azaz legyen a donor, és át pozitív töltésű ionok vagy felvesznek elektronokat egy másik atom, vagyis legyen az elfogadó, és légy negatív töltésű ionok:
N N → 0 -5e 2+;
N N → 0 -4e 4+;
N N → 0 -3E 3+;
N N → 0 2E 2+;
N N → 0 -1e 1+;
N 0 + 1e → N 1-;
N 0 + 2e → N 2-;
N 0 + 3e → N 3-.
Molekula és a nitrogénatom
nitrogén molekula két atom - N2. Jelenleg bizonyos jellemző tulajdonságok a nitrogénatom és a molekula: