kénes a természetben
Kén széles körben elterjedt a természetben. Ez volt 0,05 tömeg% a kéreg. Szabad állapotban (brimstone) található nagy mennyiségben Olaszországban (Szicília) és az Egyesült Államokban. Betétek natív kén vannak Kuibyshev régió (Volga), a közép-ázsiai államok, a Krímben és más régiókban.
Kén gyakran megtalálható vegyületek formájában más elemekkel. A legfontosabb természetes vegyületek a szulfidok fémek: FeS2 - pirit, vagy pirit; HgS - Vermilion, stb és kénsavas sók (kristályos hidrát) :. CaSO 4 ּ 2 H2O - gipsz, Na2SO4 ּ 10 H2O - Glauber-só, MgSO 4 ּ 7 H2O - Epsom Salt et al.
Fizikai tulajdonságok Kén
Természetes kén keverékéből áll négy stabil izotópok:
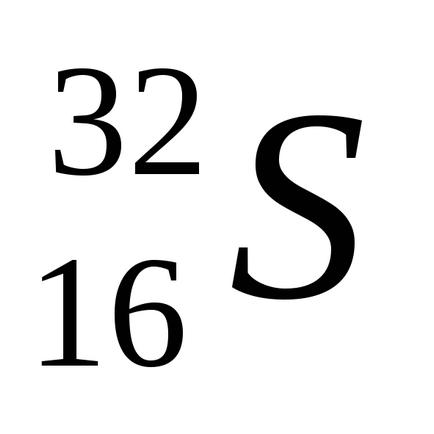

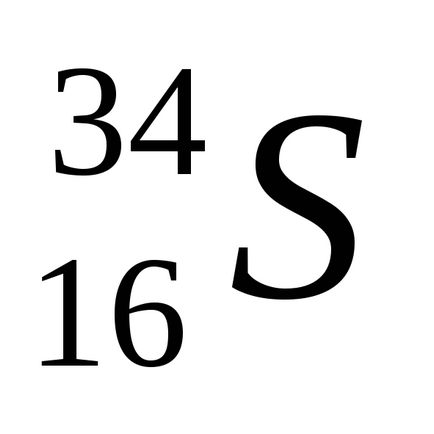
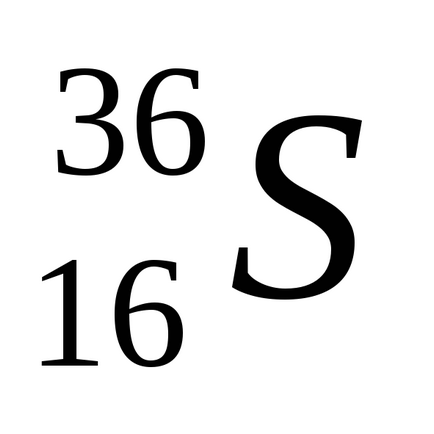
Kén formák több allotropic módosításokat. Szobahőmérsékleten stabil rombos kén egy sárga por, gyengén oldódik vízben, de oldódik szén-diszulfid, anilint és néhány más oldószerek. A rosszul vezetik a hőt és az elektromosságot. Kristályosítás hloroformaCHCl3 serouglerodaCS2 vagy ő áll egy átlátszó oktaéderes kristály formában. Rombusz alakú kén áll gyűrűs molekulS8. alakú koronát. 113 0 Cona olvad, fordult sárga hígfolyós. A további melegítés az olvadék megvastagszik, mivel beágyazódik a hosszú polimer láncok. Ha a kén melegítjük 444,6 0 C, forrni kezd,. Öntés forrásban lévő kén vékony sugárban hideg víz poluchitplasticheskuyu kén - gumival módosított, álló polimer láncok. Lassú hűtés az olvadék képződött sötét sárga tűs kristallymonoklinnoy kén. (Op = 119 0 C). Mint rombusz kén, ez a módosítás áll molekulS8. Szobahőmérsékleten, műanyag és monoklin kén instabil, és spontán módon alakítjuk rombos kénpor.
Kémiai tulajdonságait a kén és vegyületei
A tulajdonságok egy egyszerű anyag.
Kénatom, amelynek befejezetlen külső energia szinten, két elektron lehet csatolni, és oxidációs állapota -2. Ez a mértéke a kén oxidációs kiállítási vegyületek fémekkel és hidrogén (például Na2S iH2S). Visszapattanása során, vagy húzza az elektron egy atom nagyobb elektronegativitású elem fokú kén oxidációs lehet +2, +4 és +6.
Kén könnyen képez vegyületek sok eleme. Égés levegő vagy oxigén képződik kén-oxid (IV) SO2 és részlegesen kén-oxid (VI) SO3:
2S + 3O2 = 2so3
Ez a legfontosabb a kén-oxidok.
Melegítésével közvetlenül a kén kombinálódik hidrogénatom, halogénatom (kivéve a jódatomot), foszfor, szén, és emellett minden fémmel kivéve arany, platina és irídium. Például:
3S + 2P = p2s3
2S + c = CS2
Amint az a példákból, a reakciók fémekkel és néhány nemfémek ez egy kén oxidálószer, a reakciók aktívabb nemfémek, mint az oxigén, a klór, - egy redukálószerrel.
Kén-dioxid SO2 - színtelen gáz egy fojtó szúrós szagú. Amikor vízben oldjuk (a 0 0 C 1 térfogat vizet, amelyik több obemovSO2 70) kialakított kénes kislotaH2SO3. amely ismert csak oldatban.
A laboratóriumi körülmények között előállítani SO2 működni szilárd nátrium-szulfitot, tömény kénsav:
Az ipari SO2 kapunk pörköléssel szulfid ércek, mint például pirit: