Ionos és fémes kötés
Ion és fém link. Ionos és fémes kristályok
Az ionos kötés úgy végezzük közötti elektrosztatikus vonzás ellentétes töltésű ionok. Ezek az ionok képződnek elektron transzfer egy atomot egy másik. Ionos kötést képez a szénatomok között, amelynek nagy elektronegativitása különbségeket (általában nagyobb, mint 1,7 a Pauling-skála), például az atomok között az alkáli fémek és halogének.
Tekintsük a előfordulása ionos kötés kialakulását például NaCl.
Mivel az elektronikus képletek atomok
Na 1s 2s 2 2 2p 6 3s 1 és
Cl 1s 2s 2 2 2 2p 6 3s 3p 5
Ez azt mutatja, hogy a teljes külső szintje a nátrium-atom, így könnyebb egy elektron, mint hét tulajdonítanak, és klóratom könnyebb csatolni egy, mint hogy hét. A kémiai reakciók a nátrium-atom ad egy elektront, és tart egy klóratom. Ennek eredményeként az elektron pályák a nátrium és klóratomok alakítjuk elektronikus stabilitás nemesgáz (elektronszerkezet nátrium kation
Na + 1-2s 2 2 2p 6.
elektronikus konfiguráció és klór anionnal
Cl - - 1s 2s 2 2 2 2p 6 3s 3p 6).
Közötti elektrosztatikus kölcsönhatás ion a molekula képződéséhez vezet NaCl.
A természet a kémiai kötés gyakran tükröződik aggregációs állapotától és fizikai tulajdonságai az anyag. Ionos vegyületek, mint például nátrium-klorid nátrium-klorid, és a szilárd tűzálló miatt ionok közötti díjak „+” és „-” Vannak hatalmas erők az elektrosztatikus vonzás.
A negatív töltésű klorid iont vonzza nem csak a „a” ion Na +, hanem más nátrium-ionok körülöttük. Ez vezet az a tény, hogy szinte minden az ionok nem egy ion ellenkező előjelűek, és így tovább.
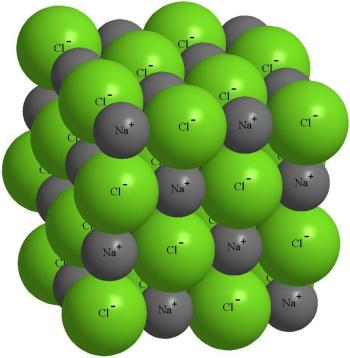
A szerkezet a kristály só NaCl.
Tény, hogy körülbelül minden 6 jelentése klór- ion, nátriumion, nátrium-ion körül minden - 6 kloridionmentesre. Egy ilyen rendezett csomagolására ionok úgynevezett ionos kristály. Ha a kristály kiosztani külön klóratom, közül a környező nátrium atomok már nem lehetséges, hogy megtalálja az egyik, amellyel a klór reagált.
Vonzódnak egymáshoz elektrosztatikus erők, az ionok rendkívül szívesen változtatják a helyzetüket hatása alatt egy külső erő vagy hőmérséklet-emelkedés. Azonban, ha a nátrium-klorid, és hogy továbbra is a hő az olvadék vákuumban, majd bepároljuk, így egy kétatomos molekula NaCl. Ez arra utal, hogy az erős kovalens kötés sohasem teljesen kikapcsol.
Főbb jellemzői az ionos kötések és ionos vegyületek tulajdonságait
1. Az ionos kötés erős kémiai kötés. Az energia e kapcsolat a sorrendben a 300-700 kJ / mól.
2. Eltérően kovalens kötés, az ionos kötés nem irányított, mert az ion lehet, hogy vonzzák ionok ellenkező előjelű bármely irányban.
3. Ezzel szemben, kovalens kötés, ionos kötés telítetlen, a kölcsönhatása ellentétes előjelű ionok nem vezet teljes kölcsönös kompenzáció azok erőtereket.
4. képződése során ionos kötések molekulákkal nincs teljes elektronok átvitelét, így az abszolút ionos kötést nem létezik a természetben. A NaCl-molekula kémiai kötés csak 80% ionos.
5. vegyületek az ionos kötéssel - olyan szilárd, kristályos anyagok magas olvadáspontú és a főzési hőmérséklet.
6. A legtöbb ionos vegyületek vízben oldjuk. Solutions vagy olvadékok ionos vegyületek villamos vezetési.
Eltérően elrendezett fém kristályok. Ha figyelembe vesszük, egy darab fém nátrium, azt találjuk, hogy megjelenése nagyon különbözik a közönséges só. Nátrium - egy puha fémből, könnyen vágható késsel, lapított egy kalapáccsal, akkor könnyen olvadnak, a csésze egy szeszes (olvadási hőmérséklete 97,8 ° C). A kristály nátrium atomonként körül nyolc másik ilyen atom.
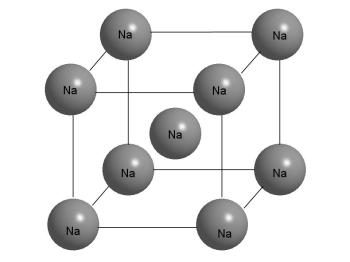
Kristályszerkezet fém nátriumot.
Az ábra azt mutatja, hogy a Na atom közepén a kocka nyolc legközelebbi szomszédai. De ugyanez mondható el más atomok a kristály, mert mind egyformák. A kristály áll „végtelenül” ismétlődő egységek, ábrázolt ezen az ábrán.
fématomok a külső energia szinten, tartalmazhat kis számú vegyérték elektronok. Mivel az ionizációs energia a fématomok kicsi, a vegyérték elektronok gyengén megtartott ilyen szénatomok. Ennek eredményeként, a kristályrácsban fémek jelennek pozitív töltésű ionok és szabad elektronok. Amelyben a fém kationok a kristályrácsban, és elektronok szabadon mozog a pozitív központokban képező úgynevezett „elektronikus gáz”.
A jelenléte kationok közötti negatív töltésű elektronok vezet, hogy minden kation kölcsönhatásba lép az elektron.
Így, a fémes kötés - a kapcsolat a pozitív fémionokat a kristályokat, ami történik az vonzereje mozgó elektronok szabadon a kristály.
Mivel a vegyérték elektronok a fém egyenletesen oszlik el a kristály fémes kötést, mint az ion nem irányított kommunikációs. Ellentétben kovalens kötés, fémes kötés egy telítetlen kötés. A kovalens kötés fémes kötés szilárdsága is különbözik. A kötési energiája a fém körülbelül 3-4-szor kisebb, mint a kovalens kötési energiát.
Mivel a nagy mobilitás a elektrongáz fémek jellemzi nagy elektromos és termikus vezetőképessége.
Fémkristály elég egyszerűnek tűnik, de valójában ő elektronikus eszköz sokkal bonyolultabb, mint a kristályos ionos sókat. A külső elektron héj a fém elemek nem elegendő elektronok alkotnak egy teljes „oktett” kovalens vagy ionos kötéssel. Ezért, a gáz halmazállapotú áll a legtöbb fém egyatomos molekulák (azaz egyedi, független atomok). Egy tipikus példa - a higanygőz. Így, a fémes kapcsolatot a fématomok fordul elő csak a folyékony és szilárd halmazállapotban.
Írja le fémes kötés a következők lehetnek: egy darab fém atomok a kapott kristályos van megadva közötti térben a vegyérték elektronok az atomok (a nátrium 3s1.), Át ionok. Mivel az összes fém atomok a kristály azonos, ezek mindegyike egyenlő esélye, hogy elveszti más vegyérték-elektron.
Más szóval, az elektron közötti átmenet a semleges és ionizált fématomok nélkül lép fel az energia. Néhány elektronok tehát mindig megjelenik a térben az atomok között formájában „elektronikus gáz”.
Ezek a szabad elektronok, egyrészt, tartsa a fématomok egy bizonyos egyensúlyi távolságra egymástól.
Másodszor, ezek adják az jellemző Metals „fémes fényű” (szabad elektronok kölcsönhatásba léphet fénykvantumokra).
Harmadszor, a szabad elektronok Metals a jó elektromos vezetőképesség. Nagy hővezetés fémek is köszönhető, hogy a jelenlévő szabad elektronok atomi tér - ezek könnyen „válaszadás” változások energia és elősegíti a gyors transzfer a kristályt.
Egy egyszerűsített modell az elektronikus szerkezet fém kristály.
** ** ** ** Például vegyük a természet a fém nátrium összeegyeztethető a fémes kötés szempontjából reprezentációi atomi pályák. Egy nátrium-atom, mint sok más fémek, van egy hiánya vegyérték elektronok, de szabad vegyértéke pályák. Az egyetlen 3s-elektron nátrium elmozdulásra képes bármely kaphatók a szomszédos energia pályák. Amikor közeledik az atomok a kristály külső pályák a szomszédos atomok átfedik, így adományozni elektronok szabadon mozoghassanak a kristály.
Azonban a „elektron gáz” nem rendetlen, mint amilyennek látszik. Szabad elektronok egy fém lapka van a átfedő pályák és legalább néhány közös, alkotó egyfajta kovalens kötések. A nátrium, kálium, rubídium, és egyéb fémes elemeket szocializálódott s-elektronok éppen elég, így a kristályok törékenyek és olvasztható. A növekvő számú vegyérték elektronok fémek szilárdság általában növekszik.
Így, a fémes kötés képzésére hajlamosak elemeket, amelyek atomok külső héjak kevés vegyérték elektronok. Ezek a vegyérték-elektron végző fémes kötés, szocializálódott hogy így mozogni a fém kristályok, és magas vezetőképességű fémből.
Crystal NaCl nem folytat villamos áram, mert a tér közötti ionok szabad elektronokat. Minden elektronok leadott nátrium-atom, mintegy maguk szilárdan tartsa kloridionmentesre. Ez az egyik alapvető különbség az ionos kristályok fém.
Amit most tudni a fémes kötés, és segít megmagyarázni a magas alakíthatósága (plaszticitás) a legtöbb fém. Fém simítsa egy vékony lemez, egy kihúzható huzal. Az a tény, hogy az egyes rétegek a fématomok a kristály viszonylag könnyen csúszik egyik a másik fölött: egy mozgatható „elektron gáz” fonnyasztjuk folyamatosan mozgó egyedi pozitív ionok, árnyékolás őket egymástól.
Természetesen semmi ehhez hasonló nem lehet elvégezni a konyhasó, hanem só - szintén kristályos anyag. Ionos kristályok, vegyérték elektronok erősen kötődnek a atommag. A váltás az egyik a másikhoz képest réteg ionok vezet a konvergencia ionok azonos töltésű, és okoz erős taszító közöttük, ami a pusztulását a kristály (NaCl - rideg anyag).
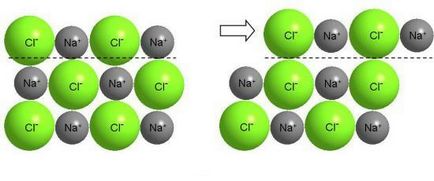
Az elmozdulás a rétegek egy ionos kristály okoz nagy taszítóerők ionok között az azonos nevű, és a pusztítás a kristály.