redox
elektródpotenciálok
Az ISI redukáló oxidánsok elektrontranszfer történik történő közvetlen érintkezés a részecskék, és a kémiai reakció energiát hővé alakul. Az energia minden ISI. áramló az elektrolit oldatban. Meg lehet alakítani elektromos energiává. Például, ha a redox folyamatokat vannak osztva térben, azaz a csökkentve az elektronátvivő fog bekövetkezni elektromos vezetéken keresztül. Ezt végre galvánelemek, ahol az elektromos energiát kapunk az kémiai energiáját egy redox reakcióban.
Vegyünk egy galvánelem Daniel Jacobi. ahol a bal oldali tartály oldattal töltött cink-szulfát ZnSO4. egy alacsonyabb, ott a cink lemez, míg a jobb edény - a réz-szulfát oldat CuSO4. lesüllyesztett neki a rézlemez.
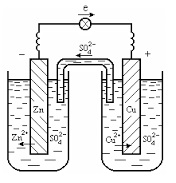
A közötti kölcsönhatás az oldathoz, és a lemezt, amely úgy működik, mint egy elektróda, hozzájárul az a tény, hogy az elektród szerzett az elektromos töltés. Az így kapott fém határfelületén az elektrolit-oldatot potenciális különbség az úgynevezett elektród potenciál. Ennek értéke és a megjelölés (+ vagy -) természete határozza meg az oldat és a fém abban található. Amikor elmerül a megoldások fémsók aktívabbak (Zn, Fe, stb) Legyen negatív töltésű, és a kevésbé aktív (Cu, Ag, Au, stb) pozitív.
Az eredmény vegyület cink és rézlemez villamos vezető, a a előfordulása az elektromos áram az áramkörben miatt az elektronok áramlását, a cink-réz a vezető lemezzel.
Így van csökkentése a elektronok száma a cink, amelyek kompenzálják átmenet Zn 2+ oldatban, azaz egy cink oldódását az elektróda - az anód (oxidációs folyamat).
Másfelől, az elektronok száma kompenzálja növekedés réz szívást rézionok az oldatban lévő, felhalmozódását eredményezi a réz a réz elektróda - a katód (redukciós folyamat):
Így egy elem ilyen reakció fordul elő:
Mennyiségileg jellemzésére redox folyamatok lehetővé teszik elektród potenciál, mért relatív a normál hidrogén-elektród (a potenciális nullának tekintjük).
Ahhoz, hogy meghatározzuk a standardpotenciál alkalmazunk olyan elem, amely az egyik elektród egy teszt fém (vagy a nemfémes), és a másik jelentése hidrogénatom elektród. Szerint talált potenciális különbség a pólusok az elem határozza meg a normál potenciál a fém.
redox
Az értékek a redox potenciál van szükség abban az esetben, irányát meghatározó a reakciót vizes vagy egyéb megoldásokat.
így a jodid-ionokat és a vas-ionok kicserélve elektronok vezetőn át. A fiolákat tartalmazó oldatokat a Fe 3+, és I -. tegye inert (szén vagy platina) elektródok és zárja le a belső és a külső áramkörrel. Az áramkör generál elektromos áramot. Jodidionok adományoz az elektronok, amely átfolyik a vezetőt az inert merített elektródák sóoldatban a Fe 3+:
oxidációs-redukciós folyamatok fordulnak elő a felületén az inert elektród. Lehetséges, amely akkor fordul elő határán inert elektród - oldattal és egyaránt tartalmaz oxidot, redukált forma nevű anyag egyensúlyi oxidációs-redukciós potenciálját. Az érték a redoxpotenciál sok tényezőtől függ. beleértve, mint például:
- Nature anyag (oxidálószer és redukáiószer)
- A koncentráció az oxidált és redukált formája. A hőmérséklet 25 ° C-on és 1 atm. értéke a redox potenciál alkalmazásával számítjuk a Nernst-egyenlet:
E - A redox-potenciál egy adott pár;
E ° - standard potenciálja (mért Juice = Cvos);
R - gázállandó (R = 8314 J);
T - abszolút hőmérséklet, K
N - mennyisége adását vagy elektronok egy redox folyamat;
F - a Faraday-állandó (F = 96484,56 C / mol);
Juice - koncentráció (aktivitás) a oxidált formában;
Cvos - koncentráció (aktivitás) a redukált forma.
Behelyettesítve az ismert adatok és lépj közös logaritmusok kapjuk az alábbi formában a következő egyenletet:
- A oldat savassága. A párok az oxidált forma, amely oxigént (például, CR2 O7 2- CrO4 2- MnO4 - ..) A redoxpotenciál csökkenésével az oldat pH növekszik, azaz a kapacitás növekedésével nő H +. Ezzel szemben, a redox potenciál csökkenésével csökken H +.
- Hőmérsékletet. Ahogy a hőmérséklet növekszik a redox-potenciál egy adott párt is növekszik.
Normál redoxpotenciálok bemutatott táblázatok speciális könyvtárakat. Meg kell érteni, hogy csak úgy véli, a reakciót vizes oldatban hőmérsékleten ≈ 25 ° C-on Ezek a táblázatok lehetővé teszik, hogy bizonyos mennyiségű következtetéseket:
- A nagyságát és előjelét szabvány redoxpotenciálok. lehetővé teszik, hogy megjósolni, hogy mi tulajdonságok (oxidáció vagy redukció) lesz atomok, ionok, vagy molekulák, kémiai reakciók, így például
E ° (F2 / 2F -) = +2,87 V - erős oxidálószer
E ° (K + / K) = - 2924 V - erős redukáló
Ez a pár lesz a nagyobb regenerációs képessége, mint a szám növeli a negatív potenciál és oxidáló képessége nagyobb, annál pozitívabb potenciálon.
- Lehetséges, hogy melyik a vegyületek egyik eleme lesz a legerősebb oxidáló vagy redukáló tulajdonságokkal.
- Lehet megjósolni az irányt a IAD. Köztudott, hogy a munka az elektrokémiai cella kerül sor azzal a feltétellel, hogy a potenciális különbség értéke pozitív. OVR áramlás a kiválasztott irányban is lehetséges, ha a potenciálkülönbség a értéke pozitív. IAD felé folyik gyengébb oxidáló és redukáló szerekkel az erősebb, például a reakció a
Sn 2+ + 2Fe 3+ = Sn 4+ + 2Fe 2+
Gyakorlatilag áramlik a előrefelé, mint
Cu + Fe 2+ = Cu 2+ + Fe
lehetetlen előre irányba áramlik csak jobbról balra, mint
A kezdeti mennyisége OVR anyagok csökken, miáltal az oxidálószer E csökken, és E a redukálószer növekszik. A A reakció befejeződése, azaz bekövetkezésekor a potenciálok mindkét vonalban vannak folyamatok kémiai egyensúly.
- Ha ilyen körülmények között folyhat tovább OVR, az első dolog, hogy a reakció megy végbe, ahol a különbség redoxpotenciál maximum.
- A referenciaadat lehet meghatározni EMF reakciót.
Tehát, hogyan EMF reakció?
Vegyünk egy pár válaszokat, és megtudhatjuk, hogy EMF:
E ° (Mg 2+ / Mg) = - 2,36 In
E ° (Fe2 + / Fe) = - 0,44 In
Annak megállapításához, az EMF reakciókat kell találni a különbséget oxidálószer lehetőségeit és potenciálját a redukálószer
Emf = E 0 C - E 0 visszaállítása
- EMF = - 0,44 - (- 2,36) = 1,92 a
- EMF = 0,00 - (- 2,36) = 2,36 a
- EMF = + 0,34 - (- 2,36) = 2,70 a
Az összes fenti reakciók végbe előrefelé, mint EMF> 0.
Az egyensúlyi állandó.
Ha szükségessé válik, hogy meghatározzuk a reakció mértéke, akkor az egyensúlyi állandó.
Például, a reakciót
Zn + Cu 2+ = Zn 2+ + Cu
Alkalmazása a tömeghatás törvénye. felírható
Itt, az egyensúlyi állandó K jelzi egyensúlyi koncentráció aránya a cink ionok és a réz.
Az érték a egyensúlyi állandó lehet kiszámítani, hogy az egyenlet a Nernst
Behelyettesítve egyenlet értékeinek a standard potenciálok párok Zn / Zn 2+ és Cu / Cu 2+. találunk
Az érték a egyensúlyi állandó azt jelzi, hogy a reakció majdnem a végén, azaz a mindaddig, amíg a réz-ion koncentráció nem válik 10 37,7-szer kisebb, mint a cinkionok koncentrációja.
A egyensúlyi állandó és a redox potenciál vannak összekötve a következő általános képlettel:
K - egyensúlyi állandó
E1 és E2 0 0 - szabványos potenciálok az oxidálószer és a redukáiószer rendre
n - az elektronok száma, hogy egy redukálószerrel vagy oxidálószer elfogadott.
0, ha E1> E2 0. Ekkor LGK> 0 és K> 1. Ezért, a reakció lefolyását az előre irányban (balról jobbra), és ha a különbség (0 E1 - E2 0) elég nagy, szinte a végéig.
Épp ellenkezőleg, ha E1 0 Ismerve az értéke az egyensúlyi állandó. anélkül, hogy a kísérleti adatok, lehetőség van megítélni a mélység a kémiai reakció. Meg kell jegyezni, hogy a standard potenciál az adatok értékei nem lehetséges mértékének meghatározása a létesítmény a reakció egyensúlyát. Szerint asztalok redoxpotenciálok lehet találni az értékek az egyensúlyi állandók mintegy 85.000 reakciókat. Az az IUPAC kell követni annak érdekében, hogy megfelelően rögzíti az áramkör sejtek és a rájuk válasz: Így, az a sejtek elkészítéséhez áramkör a bal rögzítő elektróda, amelynek oxidációs folyamatot (anód), és a megfelelő - elektródája, amelyhez a helyreállítási folyamat (katód). Például, alkotunk az áramkör az elektrokémiai cella. amelyben az alábbi reakció szerint: Az elektrokémiai cella anód vas elektróda és a katód - kadmium. Tipikus probléma megoldást, itt megtalálja.Hogyan hozzunk létre egy táblázatot a sejt?
Kapcsolódó cikkek