kémiai egyensúly
2.3 ábra - A függőség felgyorsítja a forward és reverz reakciókat időről τ. kémiai egyensúly akkor jelentkezik, ha az egyenlőség ilyen sebességgel.
Mivel az áramlás a reakció kiindulási anyagok fogyasztása és azok koncentráció csökken. Ezzel egyidejűleg, a reakció termékek jelennek meg, ezek a koncentráció nő. Következésképpen a fordított reakció kezdődik, hogy menjen, és a sebessége fokozatosan növekszik. Amikor a sebesség az előre és hátra reakciók azonosak, a kémiai egyensúly bekövetkezik. Ez a dinamikus - ellentétben a statikus egyensúly, ami nem kíséri semmilyen mozgást. Például, a mechanikus mérleg súlyok statikus. mert Bár a az anyagok koncentrációjának a rendszer állandó marad, a reakció is folyik mind előre és hátra irányban.
Az arány a sebességi állandók a forward és reverz reakciókat (K) az úgynevezett egyensúlyi állandó. Állandó hőmérsékleten, az egyensúlyi konstans állandó jelző koncentrációja arányának a termékek és a kiindulási anyagok, amelyek székhelye az egyensúlyi állapotban. Nagysága a K természetétől függ a reagensek és a hőmérséklet.
A rendszer egyensúlyban van, ameddig a külső körülmények állandó marad. Amikor a koncentrációját minden résztvevő anyagok a reakció egyensúlyát eltolja eltolódása miatt az egyensúlyi ideiglenes zavar egyforma sebességgel forward és reverz reakciókat. Ha az arány az előre reakció magasabb, akkor azt mondjuk, hogy az egyensúly eltolódik jobbra, ha a fenti fordított reakció sebességét, azt feltételezzük, hogy az egyensúly balra tolódik. Egy bizonyos idő elteltével, az egyenlő sebességgel ismét helyreáll, azaz a jön egy új egyensúlyi állapotot. felé áramlását az anyag; miközben csökkenti a koncentrációját anyagok bármelyike, eltolódik az egyensúly kialakulását az anyag.
Amikor a gázok vesz részt a reakcióban, az egyensúlyi lehet zavart, ha a nyomás:
A növekvő nyomás, például, 2-szeres koncentráció az egyes gázok növeli 2-szer, és az új reakciósebesség egyenlővé válik Vred „és VOB”.
Különböző változás sebességét előre és hátra reakciók annak a ténynek köszönhető, hogy a bal és jobb oldalán reakcióegyenlet eltérő számú gázmolekulák. Ebben az összefüggésben az egyensúlyi nyomás növekszik eltolódik számának csökkentése gázmolekulák; a lefelé irányuló nyomást.
A hőmérséklet hatása az egyensúlyi állandó. A reakcióhőt lehet tekinteni, mint a különbség a aktiválási energiákat a forward és reverz reakciók
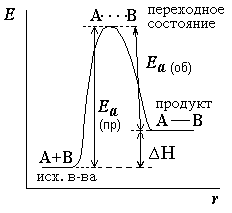
Az energia diagramon látható, hogy a termikus hatás δ H reakció valóban egyenlő a különbség az aktiválási energiák.
δ H = Ea (PR) - Ea (v). Endoterm reakciók δ H> 0; az exoterm reakciókat δ H <0. Согласно уравнению Аррениуса *. зависимость константы равновесия от температуры можно выразить следующим образом:
Az egyenletből, kötési egyensúlyi állandó a termikus hatás δ H. Ebből következik, hogy a hőmérséklet növelésével az egyensúlyi endoterm reakció az endoterm reakció megy végbe a hőfelvétel. jobbra tolódik, és az exoterm reakció exoterm reakció játszódik le hőfejlődés. - a bal oldalon. Az is kiderült, hogy a katalizátor * nem befolyásolja az egyensúlyi állandó, mivel ez csökkenti az aktiválási energia * Az előre és hátra reakciók ugyanarra az értékre.
Minták jelennek meg a példák azt mutatják bizonyos esetekben az általános elvet. meghatározzuk a különböző tényezők az egyensúlyi rendszer. Ez az elv a Chatelier: Ha a rendszer egyensúlyban van, semmilyen hatással, az eredmény eljáró feldolgozza az egyensúly eltolódott olyan irányban, hogy a meghosszabbított hatása csökkenni fog.