Típusai törés a kötések a molekulák szénhidrogén
Bonds molekulákban a szénhidrogének és lehet törés homolytically heterolytically.
Homolitikusan kötvények vezet a szabad gyökök képződését. Kötése annyira leromlik, hogy minden egyes fragmentum a molekula oc-felolvasztott egy elektron:
Homolitikusan fordul elő leggyakrabban, ha termikus szénhidrogének átalakítására.
Heterolitikus szakadás kialakulásához vezet az ionok. Kötése annyira leromlik, hogy a pár az elektronok alakítjuk teljesen az egyik mu-atomok, egy kötést képez
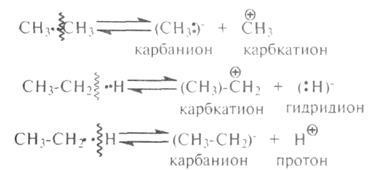
Szénhidrogén gyökök, ionok (karbokationok, karbanionok), hidrogén (H "), gidridion (H, :)" és a proton (H +) köztes-TION részecskék folyamatokban katalitikus termikus átalakulások szén-hidrogének. Ezek nagy reakcióképesség. Goethe-rolitichesky leválasztásáról csak akkor következik be, ha a katalitikus átalakítására szénhidrogének. Emellett egy teljes szakadás kötvények is előfordulhat részleges azok rés (rés egy vagy erős elektron-polarizációja kommunikáció) hatására az aktív centrum a katalizátor (elektron akceptor - A):
A hemolitikus leválasztás kevesebb energiát igényel, mint a hetero-litikus, mivel az utóbbi esetben energiát kell fordított leküzdésére elektrosztatikus kölcsönhatása ionok. Több Men-Shai szükséges energiát, hogy szakadjon egy elektron (egy elektron transzfer). Először elektron transzfer koncepció hetero-litikus reakciók fejeztük OY-Ohlo bystinym 1. A szovjet kutatók jelenleg telepített jelentős szerepe elektron transzfer a katalitikus átalakítása szénhidrogének miatt 2. Egy fontos jellemzője a szükséges energiát a hemolitikus rés, nevezett kötés disszociációs energia.
Meg kell különböztetni miatt fogalmát az energia (E) a kötés disszociációs energia fogalmak (D) a komplex molekulák (több mint kétatomos-TION).
Mismatch energia C-H kötés disszociációs energia és annak közepén annak a ténynek köszönhető, hogy a disszociációs metán molekula C-H következtében megváltozott geometriai con-figuráció rendszer és a vegyérték-állapotú a szénatom. Metán-molekula - tetraéder, a bezárt szög a vegyértékek 109 ° 28”. Me-Teal - lapos részecskéket. A szög a vegyértéke azonos 120 °.
Ahhoz, hogy menjen a CH4 molekulák tetraéderes (SP 3 - hibridizáció szénatom), hogy a lapos szerkezet bromid (SP 2 - hibridizáció szénatom), szükség van Nehéz-tit energiát, így az energia dis-sociation kommunikációt média-CH energiáját, hogy csatlakozás 1 .
disszociációs kötési energia megegyezik az aktiválási energiával bomlási mo-gyökök a molekula már inverz-értékű gyökös reakció egy olyan vegyület, nulla aktiválási energia. Ezért, a kísérleti meghatározása disszociációs energia-áció a C-C tudnia kell a függőség a sebességi állandóit a bomlási a molekula miatt a hőmérséklet:
ahol A - frekvenciaoszcillációkhoz felszakítható kapcsolatot október 13. C -1. Ugyanez egyenlet logaritmikus formában:
Építésével ez a kapcsolat grafikusan (57. ábra) által meghatározott érintő és kiszámítjuk a dőlésszög D.
Mint egyéb jellemzője kapcsolatok (hossz, dipólus momentum, és így tovább. D.), disszociációs kötési energia függ a pozícióját a molekula szénhidrogén. Táblázat. A 16. ábrán disszociációs energiáit, amely a nem-C-C kötések és C-H.
Az adatok azt mutatják, hogy a disszociációs energiája C-C kötés változik a hossza a szénhidrogén lánc és polo-zheniya kötést tartalmaz. Az energia a C-H kötés disszociációs változik jellegétől függően a szénatom - primer, szekunder-TION, tercier. Amikor egy hidrogénatom helyettesítésével Etán fenilcsoport RA-disszociációs energiája C-C kötést redukáljuk összehasonlítjuk a szubsztituálatlan etán. Általában enyhíteni hemolitikus szünetet C-C kötések, és így csökkenti az energia disszociációs korom-lelő kommunikációs közvetlenül függ a stabilitást így kialakított szabad gyökök. A kommunikáció tehát-TION disszociációs energia Salif -Calif - hexaphenylethane csak -42 kJ / mól.
Heterolitiku kötés törési energia sokkal magasabb, mint homolitikus. Értékek heterolitikus rés energiák svyazeymogut kell kiszámítani alapján az ionizációs potenciál az adatok-TION a gyökök: R „-> R + + E és az energia értékek homolitikus kötést törés. Az egyszerű mo-szénhidrogén-molekulák találhatók kísérletileg (NE-Todd elektron impakt). 2 Grinsfelderom számított diszkontinuitás értékek heterolitikus központi kötés a C-C-molekula hexánban. Ez az érték megegyezik 1089 kJ / mól. A különböző C-H kötések energiaértéke hetero-litikus rés változik 670-1689 kJ / mól.