Szén és vegyületei, a felkészülés a DH és a vizsga a kémiában
Carbon megtalálható a természetben, mind a szabad formában és az ízületek. A szabad forma megtalálható formájában allotropic módosítások - gyémánt, a grafit, karabély, fullerén.
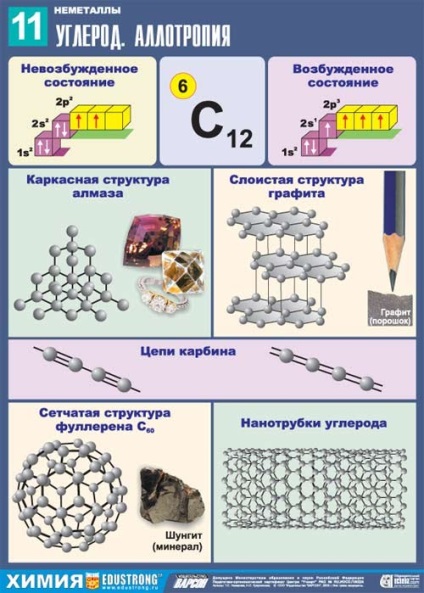
Kristályos anyag, átlátszó, erősen megtörik a fénysugarak, nagyon szilárd, nem vezetőképes, rosszul vezeti a hőt, ρ = 3,5 g / cm 3; t ° op. = 3730 ° C; t ° fűtött. = 4830 ° C-on
Lehet beszerezni a grafit p> 50 atm th .; t ° = 1200 ° C-on
Csiszolóporok, borax, üveg vágó, a vágás után - gyémánt.
Kristályos anyag, réteges, átlátszatlan, sötétszürke, és egy fémes csillogás, puha, vezeti az elektromos áramot; ρ = 2,5 g / cm 3.
Elektródák, ceruzabél, neutronmoderátor nukleáris reaktorok része valami kenőanyagok.
Fekete por; ρ = 2 g / cm 3; félvezető.
Ez áll a lineáris láncok -C = C-C = C- és = C = C = C = C =.
Hevítve, kiderül grafit.
A késő 80-es években a XX században fedezték fel egy másik allotrop módosítás - Fuller. Ez, ellentétben a gyémánt és a grafit, nem atomi, molekuláris és kristályrács.
szénatomok is képeznek üreges cső - az úgynevezett nanocső. Jelenleg fullerén és nanocsövek tekintik alapul a jövőbeli technológiákat.
szénvegyületek nagyon gyakori :. minden élőlény, szén, tőzeg, az olaj és egyéb szenet tartalmaznak. Carbon része számos szervetlen anyagok (mészkő, mész, a márvány, stb).
KÉMIAI TULAJDONSÁGAI CARBON
Carbon - maloaktiven, hideg reagál, csak fluorozott; reaktivitást nyilvánul magas hőmérsékleten.
C 0 - 4 e - → C 4 vagy C 0 - 2 e - → 2 C
Szén-monoxid (II) - CO
(Szén-monoxid. Szén-monoxid. Szén-monoxid)
Fizikai tulajdonságok: színtelen mérgező gáz nélkül íz és szag, égő kékes láng könnyebb, mint a levegő, rosszul oldódik vízben. A szén-dioxid koncentrációja a levegőben 12,5-74% robbanásveszélyes.
A formális oxidációs fokú szén-2 nem tükrözi a szerkezet a molekulák a CO, amelyben mellett a kettős kötés, esztergálás-Hívás szocializáció elektron C és D, van továbbá kialakítva a donor-akceptor mechanizmus miatt az oxigén magános elektronpár (nyíl mutatja):
Ebben a tekintetben, a CO-molekula nagyon tartós és képes lépni egy redox reakciót csak magas tempera-fordulóban. Normális körülmények között, a CO nem reagál a vízzel, lúgok vagy savak.
A fő forrása a antropogén CO CO jelenleg szolgáló kipufogógázok belső égésű motorok. A szén-dioxid égése során a tüzelőanyag belső égésű motorokban hőmérsékleten elégtelen vagy rossz beállítás egy levegő-ellátó rendszer (elégtelen oxigénellátás táplált a szénmonoxid oxidációját CO szén-dioxid CO2). In vivo képződő hiányos anaerob lebontása szerves vegyületek és a biomasszát, elsősorban a erdő és sztyepp tüzek Föld felszínén, a szén-monoxid CO.
1) Az ipar (gázofikátorok)
CO2 + C = 2CO - 175 kJ
A gáz generátor olykor a vörösen izzó szén átöblítjük gőz:
CO + H2 keveréket - úgynevezett syn - gáz.
2) A laboratóriumban, - termikus bomlása hangyasav vagy oxálsav jelenlétében H2 SO4 (konc.):
Szokásos körülmények között végzett CO inert; hevítve - redukálószer;
CO - nesoleobrazuyuschy oxid.
C +2 O + CuO t ˚ C → Cu + C +4 O2 ↑
3) klórral (fény)
Fény CO + Cl2 → COCl2 (foszgén - mérgező gáz)
4) * reagál lúgokkal olvadékok (nyomás alatt)
CO + NaOH P → HCOONa (nátrium-formiát)
Hatása a szén-monoxid az élő szervezetekre:
Szén-monoxid veszélyes, mert lehetetlenné teszi a vér oxigénszállító a létfontosságú szervek, mint a szív és az agy. Szénmonoxid egyesíti a hemoglobin, amely oxigént szállít az organizmus sejtjeiből, amelynek következtében az utóbbi alkalmatlanná válik szállítására oxigént. Attól függően, hogy az összeg a belélegzett szén-monoxid rontja koordinációs súlyosbítja a kardiovaszkuláris betegségek és a okoz fáradtság, fejfájás, gyengeség, a hatás a szén-monoxid az emberi egészségre koncentrációjától függ és az expozíciós idő a szervezetre. A szén-dioxid koncentrációja a levegőben meghaladja a 0,1% halálhoz vezet egy órán belül, és a koncentráció 1,2% három percig.
A szén-monoxid:
Főként a szén-monoxidot alkalmazunk fűtőgáz a keveréket nitrogénnel, egy úgynevezett regeneratív levegő vagy gáz, vagy víz keverékében hidrogéngázzal. A kohászati helyreállítását fémek kinyerésére ércek. A fémek nagy tisztaságú lebontásával karbonilok.
Szén-monoxid (IV) CO2 - szén-dioxid
Fizikai tulajdonságok: A szén-dioxid színtelen, szagtalan, vízben oldható - a 1V H2 O oldjuk 0,9V CO2 (normális körülmények között); levegőnél nehezebb; . T ° op = -78,5 ° C (szilárd CO2 úgynevezett "száraz jég"); Nem támogatja az égést.
A szén-dioxid a következő szerkezeti képlettel és E -