Standard hidrogén elektród
EDS elem egyenlő a különbség közötti egyensúlyi potenciálja az anód és a katód. Ha a potenciál az egyik elektród hozott nullával egyenlő, akkor a vonatkozási potenciálja E a második elem egyenlő az EMF elem. Így lehetséges, hogy meghatározzák a relatív potenciálját egyes elektródák. Jelenleg ismert csak a relatív elektródpotenciálok. A nulla elfogadott szabvány hidrogén elektród potenciálja.
A pH-elektród egy Pt - lemezt borított vékony réteg nagyon morzsalékos porózus platina, hogy növelje a felületre. A lemezt süllyesztjük 2N. vizes H2 SO4 (ábra. 62). A tevékenység a hidrogén ionok ebben az oldatban 1 g - ion / liter. Oldatot átengedjük egy kémiailag tiszta atmoszférikus nyomású hidrogénnel. Hidrogén telítettzsírsav felszíni Pt - lemez része megy át atomi állapotba H2 2H elektróda és a határ oldattal egyensúlyi H + + ↔N # 275; vagy 2H + + 2 # 275; ↔ H2.
Hidrogén elektróda hagyományosan kijelölt H 2 / 2H +. ahol a függőleges vonal jelenti a fázishatár.
Ha a hidrogén nyomása a környezeti gáz érintkezik az oldat 1 atm. A H + ionok a forgalmazási
teremt egyenlő 1 g - ion / liter. a potenciális ezt elektróda hagyományosan feltételezzük, hogy 0 és ebben az esetben az úgynevezett normál
(Standard) hidrogén elektród.
Ahhoz, hogy meghatározzuk a elektródpotenciál hidrogén összegyűjtjük skálán elektrokémiai cellában, az egyik elektródát
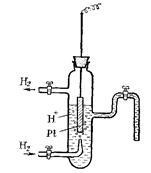
Ábra. 62. Az áramkör hidrogén elektród
amelyek mérik, és a második standard hidrogén elektród. Ábra az elem van rögzítve a következőképpen: Bal - hidrogén elektród, a jobb - mérve az elektróda. Például, a sejt áramkör mérésére az elektród potenciálja cink:
egy áramkört mérésére elektródpotenciál réz:
Mivel a lehetséges egy hidrogén elektród hagyományosan alkalmazott nulla, a mért érték egyenlő az EMF esetleges elem elektród.