Quantum szám - studopediya
A kvantummechanikában ha bebizonyosodik, hogy a Schrödinger egyenletet elégíti ki a saját funkciója. meghatározott területén három egész szám paramétereket - kvantumszámoktól: fő. orbitális és mágneses.
A főkvantumszám jellemzi a távolság az elektron a mag - pályára sugara határozza meg az energia szintjét a elektron az atom, és bármely egész szám lehet értéke egysége (= 1, 2, 3, ...). Az atomfizika, az elektron állapotok megfelelő főkvantumszámú. (= 1, 2, 3, 4, ...) is ki lehet jelölni betűk
Orbital (azimutális) meghatározza a nagysága a kvantum száma orbitális perdület (perdület) az elektron egy gömbszimmetrikus mező:
és amplitúdó eloszlása formájában az elektron hullám funkciót a atom, vagyis, az alak a elektron felhő (egy formája atomi pályák). Szintalatti meghatározza az energia szint által meghatározott főkvantumszám, és ez is igénybe vehet a értéke 0, 1, 2, ... 1. A régióban a tér, amelyben a magas megtalálásának valószínűségét egy elektron (legalább 0,95) hivatkozunk orbitális. Szerint kvantummechanika, nincs különösebb körkörös pályák az elektronok, mint a Bohr elmélet. Azáltal hullám természete Az elektron „maszatos” az űrben, mint egy „felhő” a negatív töltéssel bír. A kvantum számokat és mérete és alakja az elektron felhő, mágneses szám - felhő tájékozódás térben. A főbb típusai a betűk jelölik pályák. . . . ... (a szó éles, fő, diffúz, alapvető) .Sostoyanie elektron,
jellemzett kvantum hívott számot -országhatár = 0, = 1 - -országhatár = 2 - -országhatár = 3 - -országhatár stb Az érték a fő kvantum számát jelzi, mielőtt szimbólum orbitális kvantumszámmal Lehetséges elektron állapot (orbitális):
Tekintettel a két fő típusa a pályák (ő egyedül), (hárman), amelyben „terjed” az elektron töltés, ábrán látható.
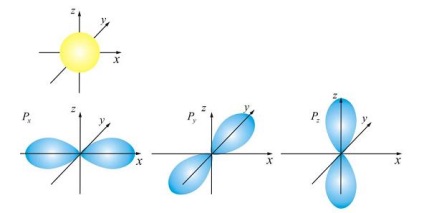
Orbital kagyló gyakran nevezik rétegekben, mert jellemzik az alakja a különböző pályák, amely képes észlelni elektronok egy rétegben (egy adott kvantum szám).
A mágneses kvantumszám - kvantum száma, meghatározza a nagysága az vetülete a perdület (perdület) az elektron egy előre meghatározott irányban (tengely - irányában mágneses mező):
A mágneses kvantumszám feltételezi február 1 egész értékeket (a), ahol - az orbitális (azimutális) kvantum számát. Az ábra azt mutatja, prektsii impulzusai pontok különböző értékeit arányok (7.5.4) és (7.5.5) azt jelzi, hogy a pillanatban az elektron és a nyúlvány e pont is kvantált értékeket.
Mindegyik (eltekintve) megegyezik különböző értékeket hullám funkciók és kvantum számokat. Ez azt jelenti, hogy a hidrogénatom lehet azonos értéke az energia, amely a különböző állapotok. Állva ugyanaz az energia nevezik degenerált száma és a degenerált állapotok azonos energiatartalom hívják degenerációja. Minden energia értéket degenerációja
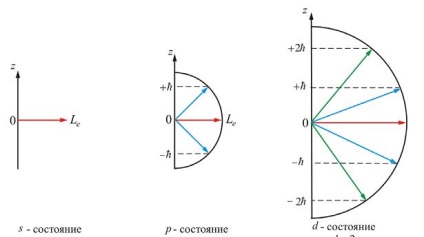
A jelenléte a mágneses kvantum számot a mágneses mező vezet felosztása a szinten főkvantumszám az al-szinteket, ami kell vezetnie a felosztása a spektrális vonalak. Felosztása az energiaszintet és olyan mágneses mezőben nazyvetsya Zeeman-effektus.
A felosztása a energiaszintek az elektromos mező nazyvetsya Stark-effektus.
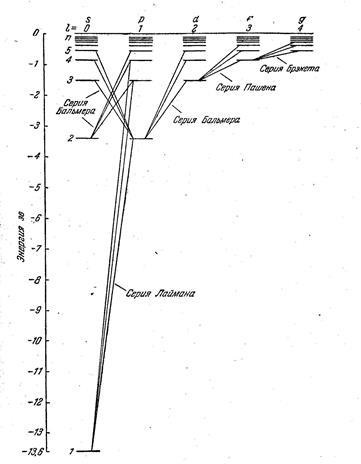
Állapot (7.5.6) az úgynevezett kiválasztási szabály, amely következtében a törvény megőrzése perdület. Tekintettel Lyman kiválasztási szabályok megfelelnek az alábbi átmeneteket a elektronok hidrogénatom: np → 1s (n = 2, 3, ...); Balmer sorozat - elektron átmenetek: np → 2s, ns → 2P, ND → 2p (n = 3, 4, 5, ...); Paschen sorozat - ahol átmenetek 4. 5, 6, ...
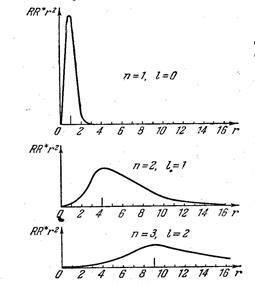
Az ábrán a valószínűség-sűrűség eloszlása különböző értékeire kvantum számok és (egységenként mérési elfogadott Bohr sugara az első pályára). A valószínűsége, hogy az elektron nullától eltérő bármely értékeket. de maximális sugara értékek egybeeső sugarak a pályák által meghatározott Bohr elmélete (7.42.16).