Ólom-oxid - kémiai enciklopédia
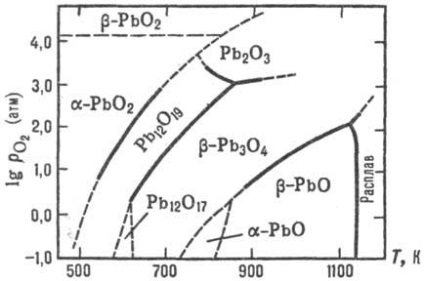
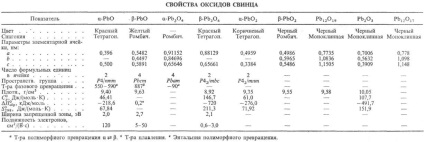
PbO-oxid két verziója létezik: egy nizkotemperaturnoy- -RbO (lithargyrum ásványi a) és b vysokotemperaturnoy- -RbO (masszikot ásványi). A készítmények eltérhetnek sztöchiometrikus határától homogenitásának STI ábrán látható. 2. A polimorf átalakulás b. egy lassabb, mint egy. b. b -RbO ezért létezhetnek szobahőmérsékleten T-re a metastabil állapotban, de megy eldörzsölés egy -pbo. PbO elpárolog kongruencia-.entno DOS. mint Pb2 O2 és O4 RB4. UR-beállított hőmérséklet-függősége gőznyomás át szilárd -RbO b: LGP (Pa) = 13,71-13,86 × 10 3 / T (887-1151 K). Ez rendelkezik félvezető-kötő meg, attól függően, hogy a készítmény (a régión belül a homogenitás) van egy elektronikus vagy p-vezetési típusú, R élesen lecsökken megvilágítás hatására.
Levegőn, 540 ° C-PbO oxidáljuk RB3 O4. 330 ° C és Rb12 O19. 370 ° C és Rb12 O17. és azok között a H2 vagy CO-csökken a fém. P-rimost (tömeg%) vízben 20 ° C-on: egy -RbO - 0,6 · 10 -3. b -pbo-1,2 · 10 -3. Jól oldódik. egy H N O3, és a p-D HC1O4. rosszabb-in sósav és a kénsav k perces képződése miatt a rosszul oldódó p-RbS12 és PbSO4. Sol. a p-PAX bázisok. képző gidroksoplyum-Baty (II), például. Na 2 [Pb (OH) 4].
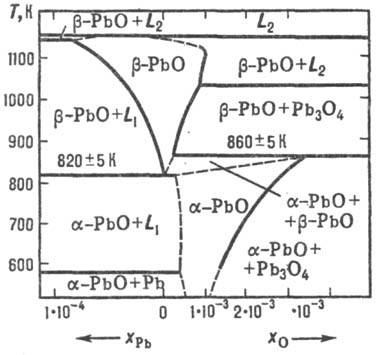
Forralásával készítették PbO Pb (OH) 2 D p-NaOH, és nagy feleslegben alkálifém készített egy -pbo, de kisebb - b -RbO. At hosszú. forrásban lévő átmenet bekövetkezik b. a. b -RbO van: Hagyományos hőenergia. RbSO3 bomlás vagy Pb (NO 3) 2. oxidációs Pb olvad (650-700 ° C) árammal O2 vagy a levegő. oxidációs svinetsorg gőz. vegyületeket (előállítása Naib. tiszta termék), PbO használt termelési-ve míniumot. al. Pb vegyületek, ólomüveg (kristály flantglas) és mázak. A festés az üveg és porcelán. gyártásához lakkok. Ezt használják fotochuv-stvit. anyag vidicon.
Ortoplyumbat (IV) ólom (II) (mínium) Rb3 O4 létezik két módosítással: alacsony hőmérsékleten és magas-b; a levegőben a fenti 570 ° C-on bomlik PbO; UR-beállított hőmérséklet-függését nyomáson lgpO2 (Pa) = bomlás 15,0-8,70 × 10 3 / T. A víz, b -Rb3 O4 rossz oldhatósága. jól oldódik. olvadni. NaNO3. p-D NSLO4; oldva HNO3 képződött PbO2 et al. kapcsolatokat. B -Rb3 O4 elő kalcinálásával finom por b -RbO 500 ° C alatt áramló levegő. Alkalmazni, mint a pigment rozsdagátló festékekben és gitt, mint az ólom akkumulátorok.
PbO2 dioxid két változatban létezik; egy -RbO2 bomlik levegőn a fűtés. séma szerint:
PbO2 gyakorlatilag nem oldódnak. a vízben. sol. egy p-PAX gidroksoplyumbatov lúgok alkotnak (IV), pl. Na 2 [Pb (OH) 6]; ha ötvözés bázikus oxidok képez plyumoaty típusú Na4 PbO4; erős oxidálószer. amikor fűtés. H2 SO4 reagál a kibocsátás O2. és sósav-C12. eldörzsölés után S vagy P vörös lángra. PbO2 oxidációjával állítottuk elő a Pb (OSOOSN3) 2 fehérítő. elektrokémiai. sói oxidációjával Pb (II), a bomlási Rb3 O4 H N O3. PbO2 használt ólom akkumulátorok és oxidálószerként (pl. Mivel a komponens megegyezik fejek).
Irod Fülkék VA Timofeev O. Fényérzékeny ólomoxidok az elektronika, L. 1979, o. 7-35; Kovtunenko PV Harif Ya. L. "Electronics Industry", 1981.. 7-8, pp. 69-73; Kulikov I. S. termodinamika oxidok. M. 1986 o. 115-25. Ya. L. Harif, PV Kovtunenko.