Okai különböző szervetlen és szerves anyagok; A kapcsolat az anyagok - studopediya



2. példa alkoholok, telített és telítetlen szénhidrogének. Ipari metanol szintézisénél.

3. Megvalósítás n s t transzformációk :. Salt - oldhatatlan bázist - fém-oxid.
Kénsav reagáltatjuk melegítés közben réz-oxid (II). Cu 2+ oldatba megy, és adja meg a kék szín.
CuO + 2H + = Cu 2+ + H2 O.
Alkáli adunk a szűrlethez, a kék csapadékot figyelhető veszteség:
CuSO 4 + 2NaOH = Cu (OH) 2 (oldhatatlan réz-oxid) + Na 2SO 4,
hevítve kék csapadékot réz-hidroxid képződött (II) fekete anyagot - a réz-oxid (II) és a víz:
Cu (OH) 2 = CuO + H2O
1. Magasabb oxigén acidChemical harmadik időszakban elemek, azok összetételét és összehasonlító jellemző tulajdonságokkal.
Foszfor képez számos oxigéntartalmú savak (oxo). Néhány ezek közül a monomer. például foszfinsav, foszforsav és foszfor (V) (ortofoszforsav). foszfor-savak lehetnek egybázisú (egy-proton) vagy multivalens (mnogoprotonnymi). Továbbá, a foszfor oxoacids képez egy másik polimer. Ilyen savak lehetnek egy aciklusos vagy ciklusos szerkezetű. Például, difoszforsav (V) (pirofoszforsav) sav dimer foszfor oxosav.
A legfontosabb ezek savak foszforsavat (V) sav (a másik neve - ortofoszforsav). Normális körülmények között, ez egy fehér, kristályos anyag szétterjed a nedvesség abszorpcióját a levegőt. A 85% -os vizes oldat ismert, mint „szirupszerű foszforsav”. Fosforntsya (V) gyenge sav háromértékű sav:
Klór savat képez több oxigenátokat. Minél magasabb a klór oxidációs ezekben savak, annál magasabb a hőstabilitás és a sav erőssége:
NOCl <НСlO2 <НСlO3 <НClO4
NClO3 és NClO4 - erős savak és NSLO4 - az egyik legerősebb valamennyi ismert savak. A fennmaradó két savas csak részben disszociált vízben és létezik egy vizes oldat előnyösen molekuláris formában. Között az oxigéntartalmú klórt csak NSLO4 savak izolálható szabad formában. A visszamaradó sav csak létezik az oldatban.
Oxidáló képesség klór oxigénezett savak növelésével csökken annak oxidációs állapotát:
HOCl és NClO2 - különösen jó oxidáló szerekkel. Például, a savas oldat NOCl:
1) ionok oxidálja a vas (II) ionok vas (III):
2) a napfény szétesik oxigén:
3), amikor felmelegítjük mintegy 75 ° C-on ez diszproporcionálódik a klorid-ionok, és a klorát (V) -ionok:
A fennmaradó elemei nagyobb savtartalmú savat a harmadik időszak (H3AlO3, H2SiO3) gyengébb, mint a foszforsav. Kénsav (H2SO4) silnae kevesebb mint klórsav (VII) sav, de erősebb, mint a foszforsav. Általában, a növekvő oxidációs foka az elem a savat kialakító növeli az erejét a sav maga:
H3AlO3 2. Általános Jellemzői, nagy molekulatömegű vegyület: összetétele, szerkezete, reakciók mögöttes azok előállítására (például polietilén vagy szintetikus gumi).

3. 3 a és d, valamint h. Kiszámítása tömege a kiindulási anyag, ha ismert gyakorlati hozammal kapjuk a terméket, és ez tartalmaz egy tömeghányad (százalékban) az elméletileg lehetséges hozam.
Feladat. Határozza meg a súlya magnézium-karbonát, hidrogén-kloriddal reagáltatjuk, ha így kapott 8,96 liter szén-monoxid (IV), ami 80% -a az elméletileg lehetséges hozam.

Közös előállítására szolgáló eljárások fémek. A gyakorlati jelentősége az elektrolízis példa anoxikus-sók.
A fémek a természetben elsősorban a forma CPD-Neny. Csak fémek alacsony reaktivitás (jó-család fémek) fordulnak elő a természetben a szabad állapotú (a platina fém, az arany, réz, ezüst, higany). Tól con struktsionnyh fémek elegendő mennyiségben állnak rendelkezésre a természetben formájában vegyületek csak vas, alumínium, magnézium. Ők alkotják hatásos tározó betétek viszonylag bo-gatyh ércek. Ez megkönnyíti a termelés nagy léptékű.
Mivel fémek a vegyületek oxidált állapotban (pozitív oxidációs állapot), a félig chenie őket a szabad állapotban csökken a RESET-MENT a folyamat:
Ez a folyamat megvalósítható kémiai vagy elektrokémiai úton.
A kémiai redukció, mint redukáló ágens leggyakrabban használt szén vagy szén-oxid (II), és a hidrogén, az aktív fémek, szilícium. Szén-oxid (II) állítjuk elő a vas (a nagyolvasztó folyamat), sok színes-átmeneti fémek (ón, ólom, cink és mások.):
Hidrogén redukciót használjuk, például a sugárzás a volfrám-oxid, volfrám (VI):
A hidrogén alkalmazása, mint a redukálószer biztosítja a legnagyobb tisztaságát a fém. A hidrogént használni ahhoz, hogy egy nagyon tiszta vas, réz, nikkel, és más me-tallium.
Eljárás fémek, ahol a RESET-NOVITEL használt fémek említett metallothermic. Ebben a módszerben, alkalmazunk redukáló aktív fémeket. Példák metallothermic reakciók:
Metallothermic kísérletek fém előállításának először egy darázs léteznek magyar tudós NN Beketov a XIX.
Fémek leggyakrabban redukciójával állítjuk elő hidroxi-sorok, ami viszont el van szigetelve a megfelelő a-natív érc. Ha az eredeti érc enyém szulfid-Rala, az utóbbit vetjük alá oxidatív-kalcinálás egy példa:
Elektrokémiai fémek előállítása végezzük elektrolízisével olvadékok megfelelő vegyületeket. Ez adja a legaktívabb fémek, alkáli-shte lochnozemelnye fémek, az alumínium, a magnézium.
Elektrokémiai redukcióját is használják az RA-Szakipari (tisztítás) „nyers” (réz, nikkel, cink, stb), előállíthatók más eljárásokkal is. Az elektrolitikus finomítás egy anód használatával „buborékcsomagolás” (AT-mesyami) fém, elektrolit - oldatot a fémvegyületek.
Előállítására szolgáló eljárások fémek végezzük magas hőmérsékleten, az úgynevezett pirometallurgiai (görög Pyr - tűz). Sok ilyen módszert ősidők óta ismert. A fordulat XIX-XX században. kezd fejleszteni hidro-metallurgiai eljárások előállítására fémek (görög hydor-víz). Ezekben az eljárásokban, a komponenseket az érc alakítjuk vizes oldattal, majd izoláljuk fém elektrolízis útján vagy kémiai redukció. Így elő, például a réz. A réz-érc, amely réz-oxid (II) CuO, kezelt híg kénsavval:
Ahhoz, hogy visszaszerezze réz kapott réz-szulfát-oldatot (II), vagy kitéve elektrolízis, vagy járhat a megoldást a vaspor.
Hidrometallurgiai folyamat nagy jövő, mivel lehetővé teszi, hogy olyan terméket kapjunk anélkül, hogy kihagyna érc a földről.
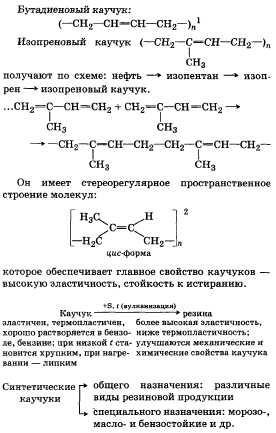
2. típusai szintetikus gumik, tulajdonságai és felhasználása.

3. A t n s a gáznemű anyag és lebonyolítása a reakciókat jellemző tulajdonságait .; (Szén-dioxid)
C02 - egy tipikus savas-oxid: reagáltatunk alkálifém (például meszes vízben elmosódik), alapvető oxidokat és vízzel.
Szén-dioxidot kapunk hatva a karbonátsó - karbonátok oldatai sósav, salétromsav és ecetsav is. A laboratóriumban, a szén-dioxid által termelt hatása kréta vagy márvány sósavban:
CaC03 + 2HCl = CaCl2 + C02 + H20 szén-dioxid
Az iparban a nagy mennyiségű szén-dioxidot égetés mészkő:
CaC03 = CaO + CO2
Kémiai reakciók szén-dioxiddal
Ha feloldva szén-oxid (IV) N2S03 formák szénsav, ami nagyon instabil és könnyen bomlik a kiindulási komponensek vízben - a szén-dioxid és víz:
CO2 + H20 -> H2CO3
Ez nem égnek vagy támogatást égés (ábra. 44), és ezért használjuk tűzoltásra. Azonban a magnézium marad a szén-dioxid-oxidot képez, és kiadja a szén formájában korom:
C02 + 2 Mg = 2MgO + C