Nitrogén (kémiai fokozatú 9)
A szerkezete és tulajdonságai atomok. Element nitrogén N - első tagja a fő csoport V a periódusos rendszer. Atomot tartalmazza a külső energia szint öt elektronokat. amelyből három páratlan elektron (Ne feledje, a szabály „8-N»). Ebből következik, hogy az atomok ezen elemek kötheti három elektron energia szintjét a külső befejezési művelet, és ezáltal megszerezni a oxidációs állapotban 3, például hidrogénnel vegyületek - ammónia NH3 és egy fém - nitrid Li3N, Mg3N2, és mások.
A nitrogénatomok is adhat a külső elektronok elektronegatívabb elemek (fluor, oxigén), és ezáltal, hogy megszerezzék a +3 oxidációs állapotban van, és +5. A nitrogénatomok mutatnak redukáló tulajdonságai és oxidációs állapotban +1, +2, +4.
Nitrogén - egy egyszerű anyag. Szabad állapotban, nitrogén létezik, mint egy kétatomos molekula M2. Ebben a molekulában két N-csoporthoz kötődik nagyon erős hármas kovalens kötés:
megadhatjuk ezt a kapcsolatot, és így:
N = N
Nitrogén - színtelen gáz szagtalan és íztelen. A víz oldja kevesebb oxigént. Erő nitrogén molekula miatt kémiai semlegesség.
Szokásos körülmények között végzett nitrogén-kölcsönhatásba lép csak lítium alkotnak nitrid Li3N:
Más fémekkel reagál csak magas hőmérsékleten.
Továbbá, a magas hőmérsékleten és nyomáson a katalizátor jelenlétében, nitrogén reagál hidrogénnel, majd ammóniával:
2N + ZN2 <-> 2NH3
(Reakciót leíró, kémiai egyensúly és megvizsgálja a torzítás feltételeket a jobb oldalon).
A hőmérséklet az elektromos ív egyesíti oxigénnel képez nitrogén-oxid (II) (jellemzése lehetővé teszik ezt a reakciót, és azt is megvizsgálja a kémiai egyensúlyi előfeszítő állapotban a jobb oldalon).
A természetben, nitrogént tartalmazott elsősorban a légkörben - 78,09 térfogat%, illetve 65,6 tömeg%. Felett minden hektáronként a föld felszínét folyamatosan „lógni” 8-án. Tonna nitrogént. Természetes szervetlen nitrogénvegyületeket, a legtöbb ismert chilei nitrát NaNO3.
A legtöbb megkötött nitrogén szerves anyagok.
Nitrogén desztillációjával kapott cseppfolyós levegő az iparban szintézisére alkalmazott ammónia és a salétromsav. Korábban ez a gáz az inert közeg feltöltésére használt villamos lámpák. Az orvostudományban tiszta nitrogént használunk inert közeg kezelésére tüdő tuberkulózis, és a folyékony nitrogént - a betegségek kezelésére a gerinc, az ízületek, stb
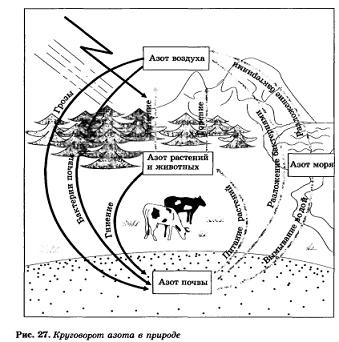
A nitrogén-ciklus a természetben. Nitrogén - létfontosságú eleme. Minden fő testrész szöveti sejtek gyártani fehérjemolekulák, amelyek közé tartozik a nitrogén. Fehérje nélkül nincs élet, és nincs fehérje, és nem a nitrogén. Ember kap fehérjéket növényi és állati élelmiszer, állatok, viszont őket is a növények. Következésképpen, a növény - egyik nitrogénforrások a feltöltési, amely fenntartja az életet.
A nitrogén egy növényi fehérje készítmény. Állatok készülj protein anyagok növények; az állati test tartalmaz 1-től 10% nitrogén (súly szerint) gyapjú és a szarvak - körülbelül 15%. Minden a legfontosabb része a sejt (citoplazmájába, magjába, a héj) vannak kialakítva fehérjemolekulák.
Még nagyobb jelentőségű a specifikus baktériumok élnek a gyökér csomók hüvelyesek (lóhere, borsó, bükköny, csillagfürt, stb), Ezek az úgynevezett „góc”. Ezek a baktériumok és megkötik a nitrogén-mentes, azaz. E. Ez vegyületekké alakíthatjuk, hogy bontják növény, amely egy test fehérjék.
Nitrogénvegyületek talajban is feltöltik, villámlás idején zuhany. Mint tudják, ez átalakul a nitrogén-oxid (IV), ahol a nitrogén és oxigén keletkezik a nitrogén-oxid (P), amely hatására a levegőben levő oxigén:
Utolsó reagáltatunk vízzel (a levegő jelenlétében oxigén) és a salétromsav kapjuk:
4NO2 + 02 + 2H20 = 4NNO3
Ez a sav, bekerülni a talajba, reagáltatjuk ott: nátrium, kalcium, kálium és formák sók - ammónium-nitrát, szükséges a növények számára (27. ábra).
Megnyitása nitrogén. 1772-ben angol tudós D. Rutherford és svéd kutató K. Scheele fedezte fel a kísérletek a gáz elégetése anyagok, amely nem támogatja a légzést és az égetés. Később, 1787-ben G. A. Lavuaze létre a gáz jelenléte a levegőben, ami nem támogatja a légzést és elégetése, és az ő javaslatára, ez a gáz nevet kapta „nitrogén”, azaz „élettelen” (a latin és -. Nem és Zoe - élet) . Más latin neve nitrogenium be 1790-ben Jean Chaptal, azt jelenti: „a szülést, hogy a nitrát.”
1. A atomok és molekulák nitrogén.
2. Nitrogén tulajdonságok: kölcsönhatás fémek, hidrogén, oxigén.
3. Készítmény folyékony nitrogén levegőből.
4. A nitrogén alkalmazása.
5. A nitrogén a természetben és a biológiai jelentősége.
Write egyenletek nitrogén interakció reakciók magnézium, kalcium, alumínium. Nézzük ezeket redox folyamatokat. Hogy van a reakciótermékek? Milyen kémiai kötés bennük, és milyen típusú kristályrács? Milyen tulajdonságokkal kell rendelkeznie reakciótermékek?
Írja be a reakciókat, amelyek elvégzésére az alábbi változásokat:
N2 -> Li3N -> NH3 -> N0 -> N02 -> HNO3
Tekintsük első reakció, mint a redox.
Írja le a reakciót különböző kritériumok szerint:
2NO + 02 <-> 2NO2 + Q
Feltételeit, az elmozdulás a kémiai egyensúly jobbra.
Határozzuk együtthatók az egyenletekben a reakciók megfelel az alábbi rendszereket, az elektronikus mérleg a módszer:
a) NH3 + 02 -> N0 + H20
b) NH3 + 02 -> N2 + H20
A laboratóriumi nitrogén-lebontásával ammónium-nitrit:
NH4N02 -> N2 + 2H20
Ha javításokat és javaslatokat a leckét, kérjük lépjen kapcsolatba velünk.
Ha azt szeretnénk, hogy a többi beállítást és javaslatokat órák, nézd meg itt - Oktatási fórum.