Móltömeg etil-alkohol (C2H5OH), példákkal
Etilalkohol moláris tömege
Etil-alkohol (etanol) - komplex anyag szerves természetű. A képviselő a homológ sorozat egyértékű alkoholok.
A szerkezet a benzol molekula ábrán látható. 1. Normál körülmények között színtelen illékony folyadék, jellegzetes szagú és égő ízét. Vízzel keverjük, és a különböző szerves oldószerek, valamint maga könnyen oldódik sok anyag (gyakran szerves természetű).
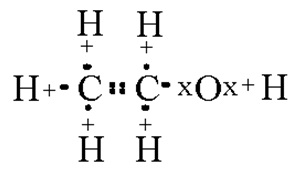
Ábra. 1. A szerkezet a molekulák etil-alkohol.
Molekuláris képlet etil-alkohol - C 2H 5OH. Mint ismeretes, a molekulatömege a molekula az összege a relatív atomi tömegek a atom alkotja a molekula (relatív atomtömeg értékeket vett Mendeleev Periódusos Táblázat egész számra kerekítve).
Úr (C2 H5 OH) = 2 × 6 + 12 × 1 + 16 = 24 + 6 + 16 = 46.
Móltömeg (M) - a súlya 1 mol hatóanyagra vonatkoztatva. Könnyen azt mutatják, hogy a számértékek a moláris tömege, és a relatív molekulatömeg úr egyenlő, de az első érték az alábbi méretekkel rendelkezik [M] = g / mol, és egy második dimenzió:
Ez azt jelenti, hogy a molekulatömeg-etil-alkohol 46 g / mol.
Példák problémák megoldása
Kiszámítására, milyen tömegű vizet kaphatunk, ha a reakcióban a hidrogén-vette 16 g oxigén?
Az egyenlet a reakció a hidrogén és oxigén interakció:
Kiszámítjuk az oxigén képletű vegyület:
Ehhez az szükséges, hogy meghatározza a moláris tömege oxigén (atomtömegű relatív érték vett Mendeleev periódusos, egészre kerekítve). Mint ismeretes, a moláris tömege a molekula az összege a relatív atomi tömegek a tartalmaznak a molekulában (M = úr):
M (O2) = 2 × Ar (O) = 2 × 16 = 32 g / mol.
Ezután az oxigén mennyisége az anyag lesz:
n (O2) = 16/32 = 0,5 mól.
Szerint n (O2) reakcióegyenlet: n (H2 O) = 2. 2, akkor:
Találunk moltömegére víz (feltételezett kiszámításakor a fenti moltömegére oxigén, sőt ebben az esetben):
M (H2O) = 2 × Ar (H) + Ar (O) = 2 × 1 + 16 = 2 +16 = 18 g / mol.
Mi határozza meg a víztömeg:
m (H2 O) = 0,5 × 16 = 8 g
A víz tömege 8 g
Számítja ki, hogy oxigén térfogatát (STP) szükséges a kén-oxid (VI) reagáltatva a kén-oxid (IV) darabonként 6,4 g?
Az egyenlet a reakció oxigén és kén-oxid (IV) van kialakítva, mint amelynek eredményeként a kén-oxid (VI):
Kiszámoljuk a kén mennyisége oxid anyag (IV) az alábbi képlet szerint:
Ehhez az szükséges meghatározni a moláris tömege a kén-oxid (IV (a relatív atomtömeg vett Mendeleev periódusos, egészre kerekítve). Mint ismeretes, a moláris tömege a molekula az összege a relatív atomi tömegek a atom alkotja a molekula ( M = Mr):
M (SO2) = Ar (S) + 2 × Ar (O) = 32 + 2 × 16 = 32 + 32 = 64 g / mol.
Ezután a kén mennyisége oxid anyag (IV lesz:
N (SO 2) = 6,4 / 64 = 0,1 mól.
Szerint a reakció egyenletet N (SO2): n (SO3) = 2. 2, akkor:
Azt találjuk, a moláris tömege a kén-oxid (VI) (feltételezés, az oxigén a számítás a móltömeg, és valóban ebben az esetben):
M (SO3) = Ar (S) + 3 × Ar (O) = 32 + 3 × 16 = 32 + 48 = 80 g / mol.
Határozza meg a tömeg kén-oxid (VI):
m (SO3) = 0,1 × 80 = 8 g