Móltömeg a szénatom (ok), és példák a általános képletű
Karbon
Tömeg egy mól az anyag az úgynevezett a móltömeg és az M jelöli fő mértékegységben a moláris tömeg g / mol (kg / kmol).
Bármilyen kémiai vegyület kivételével molekulatömeg jellemzi relatív molekulatömegű. A relatív molekulatömeg úr - a moláris tömeg, a vegyület említett 1/12 a moláris tömege szén-12 atom (12 C). Ez egy dimenzió nélküli mennyiség.
A relatív atomtömeg Ar - a moláris tömege az anyag atom, említett 1/12 a moláris tömege szén-12 atom (12 C).
A relatív atomtömeg a szén 12,0116 amu A relatív molekulatömege egyenlő 12,0116 moláris tömege:
M (C) = úr (C) × 1 = 12,0116 mol g / mol.
Szokásos körülmények között végzett szén (atomi szerkezete az 1. ábrán látható) létezhet formájában több egyszerű anyagok - allotropic módosításokat. Ezek gyémánt és köbös kristályosodott hexagonális (lonsdalite) rendszer, és a grafit tartozó hexagonális rendszerben. Mindegyikben van egy moláris tömege egyenlő 12,0116 g / mol. Ugyancsak ismertek más formái a szén, így például faszén, a koksz, korom, carbyne, polikumulen, grafit, fullerén, nanocsövek, nanoszálak, stb astralene
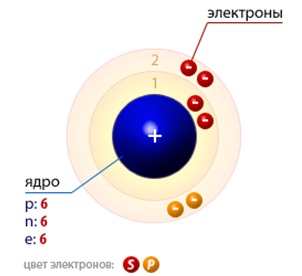
Ábra. 1. Szerkezet szénatomok.
Carbon létezhet mint gáz csak abban a formában szilárd anyagok, így annak érdekében, hogy megtalálják a értékei a molekulatömeg nem tudja használni az érték a moláris mennyiség, vagy a számítások az alábbi képlet segítségével Mengyelejev-Clapeyron.
Példák problémák megoldása
A termokémiai egyenlet tökéletlen égés a szén a következő:
2C + O2 = 2CO + 220 kJ.
Számítsuk ki a hőmennyiség, amely során felszabaduló szén égési súlyú 3 g
Ismeretes, hogy a reakció volt 3 g szén. Kiszámítjuk a súlya a kiindulási anyag a következő egyenlet alapján a reakció. Szerint a sztöchiometriai együtthatóit a szén anyagot 2 mol (N (C) = 2 mol). Azt találjuk, szén-tömeg (móltömege 12 g / mol):
m (C) = N (C) × M (C);
m (C) = 2 × 12 = '24
Ez a termokémiai reakció egyenlet azt mutatja, hogy az égés a szén-24 g 220 kJ hő szabadul. Tegyük fel, az „X” mennyiségű hőt, amely égése során felszabaduló szén-és 3 g levélírási aránya:
X = 3 × 220/24 = 27,5 kJ.
Amikor 3 g tökéletlen égés szén 27,5 kJ hő szabadul fel.
Égése során a szén tömege 187,5 g képződött szén-monoxid (IV) térfogata 336 liter (normál körülmények között). Számítsuk ki a tömeghányada szén a szén.
Az egyenlet a szén égési reakciók:
Azt találjuk, az anyag mennyiségét a szén-oxid (IV):
n (CO2) = 336 / 22,4 = 15 mol.
Szerint a reakció egyenletet N (CO2): n (C) = 1: 1, azaz a n (CO2) = N (C) = 15 mol. Kiszámítjuk a szén-dioxid-tömeg (móltömege 12 g / mol):
m (C) = N (C) × M (C);
m (C) = 15 × 12 = 180 g
Megtaláljuk a tömeges mennyiségben szén-szén:
ω (C) = m (C) / mcoal × 100%;
ω (C) = 180 / 187,5 × 100% = 96%.