molekulapályák
Korábban azt mondták, hogy az elektronok a atomok pályák. Ezek a pályák egy jellegzetes alakjuk, ami által meghatározott a kiegészítő (orbitális) kvantum számát.
Az elektronok a kovalens vegyületek a molekulapályák.
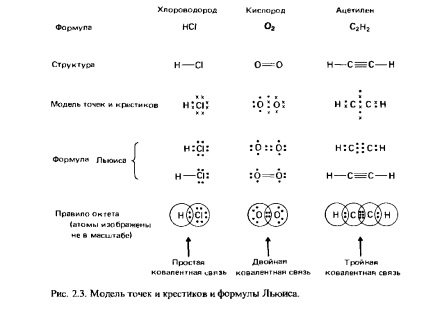
Mindegyik molekulapályák lehet egy vagy két elektron ellentétes forog. Három fajta molekulapályák: kötődés, nem-kötő és dezintegráló (antibonding) pálya.
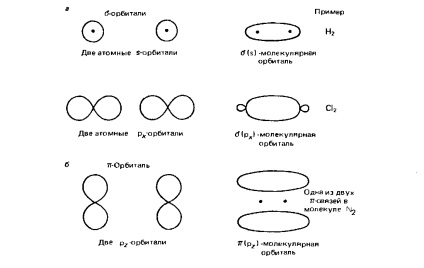
Ragasztás pályák. Ezek a pályák jelennek pontokkal és keresztek ábrán. 2.3. Ezek következtében képződött az átfedési (overlay) a atompálya-leu két szomszédos atom. Másfelől, a kötési pályák vannak osztva egy (Sigma) és p pályák (PI) pálya megfelelő a és I-kötések. A formáció a kötés az eredménye egy frontális átfedés a atomi pályák km következő típusú:
két s-pályák (2.4 ábra, a.);
két p pályák orientált egy vonal mentén (2A ábra, a.);
Egy S-orbitális és egy p orbitális orientált s-pályák (nem látható az ábrán. 2.4).
Oktatás kommunikációs jelentkezik eredményeként oldalsó (dupla) átfedik a p-pályák a két atom (ábra. 2,4,6). Az ilyen kommunikációs csak akkor következik be, ha a két atom is kapcsolódik egy-kötést. Például, a hármas kötés a molekulában N2 áll egy cikk-linkek és két I-kötést.
Nem kötő pályák. Tartós oktett az elektronok a külső héj a oxigénatom könnyen megvalósítható szocializáció kettő-hat külső elektronok oxigén atomok más (ábra. 2.5). Míg a fennmaradó négy elektron nem vesznek részt a kialakulását kötvények. Ez a négy elektronok képezik két osztatlan (azaz nem szocializált) pár.
Mindegyik tartalmaz a molekulában is van egy nitrogén magányos elektronpár. teljesen
ez öt elektronok a külső héj. Az öt közül kettőt magányos elektronpár alkotnak a nem kötő orbitális. A fennmaradó három elektron részt vesz a kialakulását a hármas kötés (ábra. 2.5), és a kötési pályák.
Antibonding orbitális. Mindegyik összekötő egy vagy I-orbitális két átfedő atomi pályák. Az elektronok orbitálok atomok a molekulában kötődnek. Azonban elektronok lehet más pályák, amennyiben ezek hozzájárulnak kikapcsolódás a molekula. Ezek a pályák nevezzük szétesést elősegítő anyagok (elektronok rájuk „lazítani” kötés a molekulában). Ahhoz, hogy kijelölje csillaggal antibonding pályák, mint például a szétesést elősegítő cikk orbitális kijelölt *. Antibonding orbitális magasabb energia, mint a megfelelő (azonos típusú vele) ragasztására orbitális (ábra. 2.6). Ezért csak az elektronok is izgatott, hogy antibonding pályák. És mivel kötőelektronok molekulákban általában megtalálható a talajban (nem gerjesztett) állapotban elektronok antibonding pályák vannak elfoglalva, az utolsó körben.